Hydro bromide
| Hydro bromide | |||
|---|---|---|---|
| |||
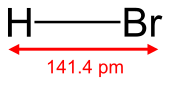 Skeletal formula of hydrogen bromide with the explicit hydrogen and a measurement added | |||
| Tên hệ thống | Bromane[1] | ||
| Nhận dạng | |||
| Số CAS | |||
| PubChem | |||
| Số EINECS | |||
| KEGG | |||
| MeSH | |||
| ChEBI | |||
| ChEMBL | |||
| Số RTECS | MW3850000 | ||
| Ảnh Jmol-3D | ảnh | ||
| SMILES | đầy đủ
| ||
| Tham chiếu Beilstein | 3587158 | ||
| UNII | |||
| Thuộc tính | |||
| Công thức phân tử | HBr | ||
| Khối lượng mol | 80.91 g/mol | ||
| Bề ngoài | Khí không màu | ||
| Mùi | Acrid | ||
| Khối lượng riêng | 3.6452 kg/m³ (0 °C, 1013 mbar)[2] | ||
| Điểm nóng chảy | Lỗi Lua trong Mô_đun:Convert tại dòng 328: attempt to compare number with nil. | ||
| Điểm sôi | Lỗi Lua trong Mô_đun:Convert tại dòng 328: attempt to compare number with nil. | ||
| Độ hòa tan trong nước | 221 g/100 mL (0 °C) 204 g/100 mL (15 °C) 193 g/100 mL (20 °C) 130 g/100 mL (100 °C) | ||
| Độ hòa tan | Tan trong alcohol, dung môi hữu cơ | ||
| Áp suất hơi | 2.308 MPa (at 21 °C) | ||
| Độ axit (pKa) | -8.8 (±0.8);[3] ~−9[4] | ||
| Độ bazơ (pKb) | ~23 | ||
| Chiết suất (nD) | 1.325[cần dẫn nguồn] | ||
| Acid liên hợp | Bromonium | ||
| Base liên hợp | Bromide | ||
| Cấu trúc | |||
| Hình dạng phân tử | Tuyến tính | ||
| Mômen lưỡng cực | 820 mD | ||
| Nhiệt hóa học | |||
| Enthalpy hình thành ΔfH | −36.45 – −36.13 kJ mol−1[5] | ||
| Entropy mol tiêu chuẩn S | 198.696-198.704 J K−1 mol−1[5] | ||
| Nhiệt dung | 350.7 mJ K−1 g−1 | ||
| Các nguy hiểm | |||
| NFPA 704 |
| ||
| PEL | TWA 3 ppm (10 mg/m³)[6] | ||
| LC50 | 2858 ppm (rat, 1 hr) 814 ppm (mouse, 1 hr)[7] | ||
| REL | TWA 3 ppm (10 mg/m³)[6] | ||
| IDLH | 30 ppm[6] | ||
| Ký hiệu GHS |   | ||
| Báo hiệu GHS | Danger | ||
| Chỉ dẫn nguy hiểm GHS | H314, H335 | ||
| Chỉ dẫn phòng ngừa GHS | P261, P280, P305+P351+P338, P310 | ||
| Các hợp chất liên quan | |||
| Hợp chất liên quan | Hydro fluoride Hydro chloride Hydro iodide Hydro astatide | ||
Trừ khi có ghi chú khác, dữ liệu được cung cấp cho các vật liệu trong trạng thái tiêu chuẩn của chúng (ở 25 °C [77 °F], 100 kPa). | |||
Hydro bromide là phân tử hai nguyên tử có công thức HBr. Nó là một hợp chất không màu và một halogen hydro. Acid hydrobromic là dung dịch HBr trong nước. Cả hai dung dịch khan và dung dịch nước của HBr đều là thuốc thử phổ biến trong điều chế các hợp chất bromide.
HBr rất hòa tan trong nước, tạo thành dung dịch acid hydrobromic, được bão hòa ở 68,85% HBr theo trọng lượng ở nhiệt độ phòng. Các dung dịch nước có trọng lượng 47,6% HBr tính theo trọng lượng tạo thành hỗn hợp azeotrope sôi liên tục, sôi ở 124,3 °C. Đun sôi các dung dịch ít cô đặc giải phóng H2O cho đến khi đạt được thành phần hỗn hợp sôi không đổi.
Công dụng của HBr
[sửa | sửa mã nguồn]Hydro bromide và hydrobromic acid là những thuốc thử quan trọng trong sản xuất các hợp chất brom vô cơ và hữu cơ.[8] Việc cộng gốc tự do của HBr vào anken sẽ tạo ra alkyl bromide:
- RCH=CH2 + HBr → R-CHBr–CH3
Các tác nhân kiềm hóa này là tiền chất của các dẫn xuất amin béo. Tương tự gốc tự do tương tự với allyl chloride và styrene cho 1-bromo-3-chloropropane và phenylethylbromide, tương ứng.
Hydro bromide phản ứng với dichloromethane để cho bromochloromethane và dibromomethane, tuần tự:
- HBr + CH2Cl2 → HCl + CH2BrCl
- HBr + CH2BrCl → HCl + CH2Br2
Allyl bromide được điều chế bằng cách xử lý rượu allyl với HBr:
- CH2=CHCH2OH + HBr → CH2=CHCH2Br + H2O
Các phản ứng khác
[sửa | sửa mã nguồn]Mặc dù không được sử dụng rộng rãi trong công nghiệp, HBr thêm vào anken để cung cấp cho bromoalkanes, một họ quan trọng của hợp chất organobromine. Tương tự, HBr thêm vào haloalkene để tạo thành một đá quý dihaloalkane. (Loại bổ sung này tuân theo quy tắc Markovnikov):
- RC(Br)=CH2 + HBr → RC(Br2)–CH3
HBr cũng thêm vào các alkyne để tạo ra bromoalken. Hóa học lập thể của loại bổ sung này thường là chống :
- RC≡CH + HBr → RC(Br)=CH2
Ngoài ra, HBr được sử dụng để mở các epoxide và lactone và trong quá trình tổng hợp các bromoacetal. Ngoài ra, HBr xúc tác cho nhiều phản ứng hữu cơ.[9][10][11][12]
Tham khảo
[sửa | sửa mã nguồn]- ^ “Hydrobromic Acid - Compound Summary”. PubChem Compound. USA: National Center for Biodechnology Information. ngày 16 tháng 9 năm 2004. Identification and Related Records. Truy cập ngày 10 tháng 11 năm 2011.
- ^ Thông tin từ [1] trong GESTIS-Stoffdatenbank của IFA
- ^ Trummal, Aleksander; Lipping, Lauri; Kaljurand, Ivari; Koppel, Ilmar A; Leito, Ivo (2016). “Acidity of Strong Acids in Water and Dimethyl Sulfoxide”. The Journal of Physical Chemistry A. 120 (20): 3663. doi:10.1021/acs.jpca.6b02253. PMID 27115918.
- ^ Perrin, D. D. Dissociation constants of inorganic acids and bases in aqueous solution. Butterworths, London, 1969.
- ^ a b Zumdahl, Steven S. (2009). Chemical Principles 6th Ed. Houghton Mifflin Company. ISBN 0-618-94690-X.
- ^ a b c “NIOSH Pocket Guide to Chemical Hazards #0331”. Viện An toàn và Sức khỏe Nghề nghiệp Quốc gia Hoa Kỳ (NIOSH).
- ^ “Hydro bromide”. Nguy hiểm ngay lập tức đến tính mạng hoặc sức khỏe. Viện An toàn và Sức khỏe Nghề nghiệp Quốc gia Hoa Kỳ (NIOSH).
- ^ Dagani, M. J.; Barda, H. J.; Benya, T. J.; Sanders, D. C. “Bromine Compounds”. Bách khoa toàn thư Ullmann về Hóa chất công nghiệp. Weinheim: Wiley-VCH. doi:10.1002/14356007.a04_405.Quản lý CS1: nhiều tên: danh sách tác giả (liên kết)
- ^ Hercouet, A.;LeCorre, M. (1988) Triphenylphosphonium bromide: A convenient and quantitative source of gaseous hydro bromide. Synthesis, 157-158.
- ^ Greenwood, N. N.; Earnshaw, A. Chemistry of the Elements; Butterworth-Heineman: Oxford, Great Britain; 1997; pp. 809-812.
- ^ Carlin, William W. Bằng sáng chế Hoa Kỳ số 4.147.601, ngày 3 tháng 4 năm 1979
- ^ Vollhardt, K. P. C.; Schore, N. E. Organic Chemistry: Structure and Function; 4th Ed.; W. H. Freeman and Company: New York, NY; 2003.



