Lưu huỳnh tetrafluoride
| Sulfur tetrafluoride | |||
|---|---|---|---|
| |||
 Cấu trúc 2D và thông số liên kết của lưu huỳnh tetrafluoride | |||
| Danh pháp IUPAC | Sulfur(IV) fluoride | ||
| Tên khác | Sulfur(IV) fluoride Sulfur tetrafluoride Lưu huỳnh(IV) fluoride | ||
| Nhận dạng | |||
| Số CAS | |||
| PubChem | |||
| ChEBI | |||
| Số RTECS | WT4800000 | ||
| Ảnh Jmol-3D | ảnh | ||
| SMILES | đầy đủ
| ||
| InChI | đầy đủ
| ||
| Thuộc tính | |||
| Công thức phân tử | SF4 | ||
| Khối lượng mol | 108,0596 g/mol | ||
| Bề ngoài | khí không màu | ||
| Khối lượng riêng | 1,95 g/cm³, -78 ℃ | ||
| Điểm nóng chảy | −121 °C (152 K; −186 °F) | ||
| Điểm sôi | -38 | ||
| Độ hòa tan trong nước | phản ứng | ||
| Áp suất hơi | 10,5 atm (22 ℃)[1] | ||
| Cấu trúc | |||
| Hình dạng phân tử | Seesaw (C2v) | ||
| Mômen lưỡng cực | 0,632 D[2] | ||
| Các nguy hiểm | |||
| Nguy hiểm chính | Rất độc, ăn mòn | ||
| NFPA 704 |
| ||
| PEL | không có[1] | ||
| REL | C 0,1 ppm (0,4 mg/m³)[1] | ||
| IDLH | N.D.[1] | ||
| Các hợp chất liên quan | |||
| Anion khác | Lưu huỳnh dichloride Disulfur dibromide Lưu huỳnh trifluoride | ||
| Cation khác | Oxy difluoride Selen tetrafluoride Telluri tetrafluoride Poloni tetrafluoride | ||
| Nhóm chức liên quan | Disulfur difluoride Lưu huỳnh difluoride Disulfur decafluoride Lưu huỳnh hexafluoride | ||
| Hợp chất liên quan | Thionyl fluoride | ||
Trừ khi có ghi chú khác, dữ liệu được cung cấp cho các vật liệu trong trạng thái tiêu chuẩn của chúng (ở 25 °C [77 °F], 100 kPa). | |||
Lưu huỳnh tetrafluoride là một hợp chất vô cơ với công thức hóa học SF4. Hợp chất này tồn tại dưới dạng khí ở các điều kiện chuẩn. Nó là một chất ăn mòn, giải phóng HF khi tiếp xúc với nước hoặc độ ẩm. Mặc dù những đặc điểm này rất có hại, hợp chất này là một chất thử hữu ích cho việc điều chế các hợp chất cơ fluor (organofluorine compounds)[3], một số trong đó có vai trò quan trọng trong ngành dược phẩm và các ngành công nghiệp hóa chất đặc biệt.
Cấu trúc[sửa | sửa mã nguồn]
Lưu huỳnh trong SF4 ở trạng thái oxy hóa +4, với một cặp electron độc thân. Do đó, cấu trúc của SF4 có thể được dự đoán dựa trên các nguyên tắc của lý thuyết VSEPR: nó có hình dạng bập bênh, với S ở giữa. Một trong ba vị trí equatorial bị chiếm bởi một cặp electron không liên kết độc thân. Do đó, phân tử này có hai loại phối tử riêng biệt, hai trục và hai xích đạo. Khoảng cách liên kết S–Fax là 164,3 pm và S–Feq là 154,2 pm. Nó là một hợp chất điển hình cho các phối tử dọc trục trong các phân tử tăng lên được liên kết ít mạnh mẽ hơn. Trái ngược với SF4, phân tử liên quan SF6 có lưu huỳnh ở trạng thái 6+, không có điện hóa trị nào không liên kết với lưu huỳnh, do đó phân tử này có một cấu trúc hình cánh diện cân đối cao. Tương phản với SF4, SF6 trơ một cách lạ thường về mặt hóa học.
Phổ 19F NMR của SF4 cho thấy chỉ có một tín hiệu, cho thấy các vị trí của các nguyên tử F axial và equatorial nhanh chóng chuyển đổi qua pseudorotation.
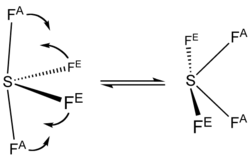
Tổng hợp và sản xuất[sửa | sửa mã nguồn]
Trong phòng thí nghiệm, lưu huỳnh tetrafluoride được điều chế từ đơn chất lưu huỳnh and và cobalt trifluoride:[4]
- S + 4CoF3 → SF4 + 4CoF2
Trong công nghiệp, SF4 được sản xuất bởi phản ứng của SCl2, Cl2 và NaF với chất xúc tác là acetonitrile:
- SCl2 + Cl2 + 4NaF → SF4↑ + 4NaCl
- Ở nhiệt độ cao hơn, (ví dụ như từ 225–450 °C), thì dung môi bị dư. Hơn nữa, lưu huỳnh dichloride có thể được thay thế bằng đơn chất lưu huỳnh (S) và chlor (Cl2).
Khi chỉ xử lí SCl2 với NaF cũng cho SF4 chứ không phải SF2. SF2 không ổn định, nó ngưng tụ với chính nó để tạo thành SF4 và S2F2. Một phuơng pháp ở nhiệt độ thấp hơn (ví dụ như từ 0–86 °C), khác với phuơng pháp trên, sử dụng brom lỏng với vai trò vừa là chất oxy hóa, vừa là dung môi:
- S(r) + 2 Br2(l) + 4KF(r) → SF4↑ + 4 KBr(brom)
Ứng dụng trong tổng hợp hợp chất cơ fluor[sửa | sửa mã nguồn]
Trong tổng hợp hữu cơ, SF4 được sử dụng để chuyển các nhóm COH và C=O thành các nhóm CF và CF2[5]. Một số alcohol có thể cho fluorocarbon tương ứng. Keton và aldehyde cho mạch difluoride. Sự hiện diện của proton alpha đến carbonyl dẫn đến phản ứng phụ và hiệu suất giảm (30–40%). Diol cũng có thể cho ester sulfite tuần hoàn, (RO)2SO. Các acid carboxylic chuyển thành dẫn xuất trifluorometyl. Ví dụ cho acid heptanoic tác dụng với SF4 ở 100–130 ℃ tạo ra 1,1,1-trifluoroheptan. Hexafluoro-2-butyn cũng có thể được sản xuất tương tự từ acid acetylendicarboxylic. Các sản phẩm phụ từ những chất fluoride này, bao gồm SF4 không phản ứng, SOF2 và SO2, độc nhưng có thể được trung hòa bằng cách xử lý với dung dịch KOH.
Việc sử dụng SF4 đang bị thay thế trong những năm gần đây do xử lý thuận tiện hơn diethylaminosulfur trifluoride, Et2NSF3, "DAST", với Et = CH3CH2.[6] Thuốc thử này được điều chế từ SF4:[7]:
- SF4 + Me3SiNEt2 → Et2NSF3 + Me3SiF
Các phản ứng khác[sửa | sửa mã nguồn]
Lưu huỳnh chloropentafluoride (SF5Cl), một nguồn hữu ích của nhóm SF5, được chuẩn bị từ SF4.[8]
Sự thủy phân của SF4 cho lưu huỳnh dioxide:[9]
- SF4 + 2H2O → SO2 + 4HF
Phản ứng này tiến hành thông qua chất trung gian là thionyl fluoride, thường không can thiệp vào việc sử dụng SF4 làm chất phản ứng.
Khi xử lí các amin với lưu huỳnh tetrafluoride sẽ thu được các aminosulfur difluoride.

Độc tính[sửa | sửa mã nguồn]
SF4 phản ứng bên trong phổi khi có độ ẩm, tạo thành lưu huỳnh dioxide và hydro fluoride - từ đó tạo thành acid hydrofluoric có độc tính cao và ăn mòn mạnh.[10] SF4 rất độc.
Tham khảo[sửa | sửa mã nguồn]
- ^ a b c d “NIOSH Pocket Guide to Chemical Hazards #0580”. Viện An toàn và Sức khỏe Nghề nghiệp Quốc gia Hoa Kỳ (NIOSH).
- ^ Tolles, W. M.; W. M. Gwinn, W. D. (1962). “Structure and Dipole Moment for SF4”. J. Chem. Phys. 36 (5): 1119–1121. doi:10.1063/1.1732702.
- ^ C.-L. J. Wang, "Sulfur Tetrafluoride" in Encychlorpedia of Reagents for Organic Synthesis (Ed: L. Paquette) 2004, J. Wiley & Sons, New York. doi:10.1002/047084289.
- ^ Kay, Jack G. (8 tháng 5 năm 1964). “Inorganic Chemistry: Handbook of Preparative Inorganic Chemistry . vol. 1. Georg Brauer, Ed. Translated from the German edition (Stuttgart, ed. 2, 1960) by Scripta Technica. Reed F. Riley, Ed. Academic Press, New York, 1963. xxviii + 1002 pp. Illus. $36”. Science. 144 (3619): 703–703. doi:10.1126/science.144.3619.703.b. ISSN 0036-8075. line feed character trong
|title=tại ký tự số 21 (trợ giúp) - ^ Hasek, W. R. “1,1,1-Trifluoroheptane”. Organic Syntheses.; Collective Volume, 5, tr. 1082
- ^ A. H. Fauq, "N,N-Diethylaminosulfur Trifluoride" in Encychlorpedia of Reagents for Organic Synthesis (Ed: L. Paquette) 2004, J. Wiley & Sons, New York. doi:10.1002/047084289.
- ^ W. J. Middleton, E. M. Bingham. “Diethylaminosulfur Trifluoride”. Organic Syntheses.; Collective Volume, 6, tr. 440
- ^ Nyman, F., Roberts, H. L., Seaton, T. Inorganic Syntheses, 1966, Volume 8, p. 160 McGraw-Hill Book Company, Inc., 1966, doi:10.1002/9780470132395.ch42
- ^ Greenwood, Norman N.; Earnshaw, A. (1997), Chemistry of the Elements (ấn bản 2), Oxford: Butterworth-Heinemann, ISBN 0-7506-3365-4
- ^ Johnston, H. (2003). A Bridge not Attacked: Chemical Warfare Civilian Research During World War II. World Scientific. tr. 33–36. ISBN 981-238-153-8.



