Fluoxymesterone
 | |
| Dữ liệu lâm sàng | |
|---|---|
| Tên thương mại | Halotestin, Ora-Testryl, Ultandren, others |
| Đồng nghĩa | Androfluorene; NSC-12165; 9α-Fluoro-11β-hydroxy-17α-methyltestosterone; 9α-Fluoro-17α-methylandrost-4-en-11β,17β-diol-3-one |
| AHFS/Drugs.com | Chuyên khảo |
| MedlinePlus | a682690 |
| Danh mục cho thai kỳ |
|
| Dược đồ sử dụng | By mouth[1] |
| Mã ATC | |
| Tình trạng pháp lý | |
| Tình trạng pháp lý |
|
| Dữ liệu dược động học | |
| Sinh khả dụng | Oral: 80%[3] |
| Chuyển hóa dược phẩm | Gan (6β-hydroxylation, 5α- và 5β-reduction, 3α- và 3β-keto-oxidation, 11β-hydroxy-oxidation)[2] |
| Chất chuyển hóa | • 5α‑Dihydrofluoxymesterone[2] • 11-Oxofluoxymesterone[2] |
| Chu kỳ bán rã sinh học | 9.2 hours[4][5] |
| Bài tiết | Urine (<5% unchanged)[3][2] |
| Các định danh | |
Tên IUPAC
| |
| Số đăng ký CAS | |
| PubChem CID | |
| IUPHAR/BPS | |
| DrugBank | |
| ChemSpider | |
| Định danh thành phần duy nhất | |
| KEGG | |
| ChEBI | |
| ChEMBL | |
| ECHA InfoCard | 100.000.875 |
| Dữ liệu hóa lý | |
| Công thức hóa học | C20H29FO3 |
| Khối lượng phân tử | 336.441 g/mol |
| Mẫu 3D (Jmol) | |
SMILES
| |
Định danh hóa học quốc tế
| |
| (kiểm chứng) | |
Fluoxymesterone, được bán dưới tên thương hiệu Halotestin và Ultandren, là một loại thuốc androgen và đồng hóa steroid (AAS) được sử dụng trong điều trị nồng độ testosterone thấp ở nam giới, dậy thì muộn ở trẻ em trai, ung thư vú ở phụ nữ và thiếu máu.[1] Nó được dùng bằng đường miệng.[1]
Tác dụng phụ của fluoxymesterone bao gồm các triệu chứng nam tính như mụn trứng cá, tăng trưởng tóc, thay đổi giọng nói và tăng ham muốn tình dục.[1] Nó cũng có thể gây tổn thương gan và tác dụng phụ về tim mạch như huyết áp cao.[1][6][7] Thuốc là một steroid tổng hợp androgen và đồng hóa và do đó là chất chủ vận của thụ thể androgen (AR), mục tiêu sinh học của androgen như testosterone và dihydrotestosterone (DHT).[1][8] Nó có tác dụng androgen mạnh mẽ và hiệu ứng đồng hóa vừa phải, làm cho nó hữu ích cho việc sản xuất nam tính.[1][9]
Fluoxymesterone được mô tả lần đầu tiên vào năm 1956 và được giới thiệu sử dụng trong y tế vào năm 1957.[1][10] Ngoài việc sử dụng trong y tế, fluoxymesterone được sử dụng để cải thiện vóc dáng và hiệu suất.[1] Thuốc là một chất được kiểm soát ở nhiều quốc gia và vì vậy sử dụng phi y tế nói chung là bất hợp pháp.[1]
Sử dụng trong y tế
[sửa | sửa mã nguồn]Fluoxymesterone đang hoặc đã được sử dụng trong điều trị suy sinh dục, dậy thì muộn và thiếu máu ở nam giới và điều trị ung thư vú ở phụ nữ.[1][11] Nó được phê duyệt đặc biệt ở một hoặc nhiều quốc gia trong điều trị suy sinh dục ở nam giới, dậy thì muộn ở trẻ trai và ung thư vú ở phụ nữ.[12] Các hướng dẫn kê đơn hiện tại ở Hoa Kỳ chỉ liệt kê việc điều trị thiếu hụt androgen ở nam giới và ung thư vú ở nữ giới.[1]
| Lộ trình / hình thức | Androgen | Liều dùng | |
|---|---|---|---|
| Uống | Methyltestosterone | 30 con200 mg / ngày | |
| Fluoxymesterone | 10 con40 mg 3x / ngày | ||
| Calusterone | 40 mg 4x / ngày | ||
| Normethandrone | 40 mg / ngày | ||
| Tiêm <abbr title="<nowiki>Intramuscular</nowiki>">IM | Testosterone propionate | 50 con100 mg 3x / tuần | |
| Testosterone enanthate | 200 sắt400 mg 1x / 2 trận4 tuần | ||
| Testosterone cypionate | 200 sắt400 mg 1x / 2 trận4 tuần | ||
| Methandriol (<abbr title="<nowiki>aqueous suspension</nowiki>">aq. Nghi ngờ.) | 100 mg 3x / tuần | ||
| Androstanolone (<abbr title="<nowiki>aqueous suspension</nowiki>">aq. Nghi ngờ.) | 300 mg 3x / tuần | ||
| Thuốc nhỏ giọt propionate | 100 mg 3x / tuần | ||
| Nandrolone decanoate | 50 trận 100 mg 1x / 1 trận3 tuần | ||
| Nandrolone phenylpropionate | 50 con100 mg / tuần | ||
| Lưu ý: Liều dùng không nhất thiết phải tương đương. Nguồn: Xem mẫu. | |||
Sử dụng phi y tế
[sửa | sửa mã nguồn]Fluoxymesterone được sử dụng cho mục đích tăng cường hiệu suất bằng cách cạnh tranh vận động viên, người tập thể hình, và người tập tạ.[1]
Tác dụng phụ
[sửa | sửa mã nguồn]Tác dụng phụ đã được gắn liền với fluoxymesterone bao gồm mụn, phù nề, tăng tiết bã nhờn/viêm da tiết bã, rụng tóc, rậm lông, giọng nói sâu sắc, nam hóa nói chung, đỏ bừng mặt, gynecomastia, đau vú, rối loạn kinh nguyệt, thiểu năng sinh dục, teo tinh hoàn, mở rộng âm vật, mở rộng dương vật, priapism, tăng tính hung hăng, phì đại tuyến tiền liệt, độc tính tim mạch và nhiễm độc gan, trong số tác dụng khác.[1][13]
Dược lý
[sửa | sửa mã nguồn]Dược lực học
[sửa | sửa mã nguồn]| Thuốc | Tỉ lệ |
|---|---|
| Testosterone | 1: 1 |
| Testosterone cypionate | 1: 1 |
| Testosterone enanthate | 1: 1 |
| Methyltestosterone | 1: 1 |
| Fluoxymesterone | 1: 2 |
| Oxymetholone | 1: 3 |
| Oxandrolone | 1: 3 Vé1: 13 |
| Nandrolone decanoate | 1: 2.5 Từ1: 4 |
| Nguồn: Xem mẫu. | |
Là một AAS, fluoxymesterone là một chất chủ vận của thụ thể androgen (AR), tương tự như androgen như testosterone và DHT.[1][14] Nó là chất nền cho 5α-reductase như testosterone, và do đó được tăng cường trong các mô được gọi là "androgenic" như da, nang lông và tuyến tiền liệt thông qua chuyển đổi thành 5α-dihydrofluoxymesterone.[1][14] Như vậy, fluoxymesterone có tỷ lệ đồng hóa tương đối kém với hoạt động của androgen tương tự như testosterone và methyltestosterone.[1][14] Tuy nhiên, fluoxymesterone dù sao cũng ít androgenic và đồng hóa hơn so với methyltestosterone và testosterone.[9]
Fluoxymesterone đã được báo cáo là không aromatizable do sự cản trở không gian của nhóm hydroxyl C11β của nó,[15] và do đó không được coi là có xu hướng tạo ra các hiệu ứng estrogen như gynecomastia hoặc giữ nước.[1][16] Tuy nhiên, nghịch lý là, một báo cáo trường hợp của gynecomastia gây ra bởi fluoxymesterone nghiêm trọng, và gynecomastia liên quan đến fluoxymesterone cũng đã được báo cáo trong các ấn phẩm khác, mặc dù điều này có thể không phải do hoạt động estrogen.[17] Fluoxymesterone được cho là có ít hoặc không có hoạt động proestogen.[1][14]
Do sự hiện diện của nhóm 17-methyl của nó, quá trình chuyển hóa của fluoxymesterone bị cản trở, dẫn đến nó hoạt động bằng miệng, mặc dù cũng gây độc cho gan.[1][14]
Ức chế 11β-HSD
[sửa | sửa mã nguồn]Fluoxymesterone đã được tìm thấy hoạt động như một chất ức chế mạnh 11β-hydroxapseoid dehydrogenase loại 2 (11β-HSD2) (IC50 = 60 Nott630 nM), với hiệu lực tương đương với axit glycyrrhetinic ức chế 11β-HSD2.[6][7] Hành động này của fluoxymesterone là duy nhất trong AAS và có khả năng liên quan đến nhóm 11β-hydroxyl của nó.[6] 11β-HSD2 chịu trách nhiệm cho sự bất hoạt của glucocorticoids cortisol và corticosterone (tương ứng thành cortisone và 11-dehydrocorticosterone).[6][7] Sự ức chế 11β-HSD2 của fluoxymesterone có thể dẫn đến quá trình thụ thể của khoáng chấtocorticoid và các tác dụng phụ liên quan như tăng huyết áp và giữ nước, và đã được đưa ra giả thuyết có liên quan đến tim mạch và các tác dụng phụ khác của fluoxymesterone.[6][7]
Hoạt động của glucocorticoid
[sửa | sửa mã nguồn]Không giống như AAS khác, fluoxymesterone có đặc điểm cấu trúc chung với corticosteroid, trong đó có C9α nó fluoro và C11β nhóm hydroxyl.[18] Liên quan đến vấn đề này, nó có ái lực yếu (micromol) nhưng có khả năng có ý nghĩa lâm sàng đối với thụ thể glucocorticoid.[19]
Dược động học
[sửa | sửa mã nguồn]Fluoxymesterone có khoảng 80% sinh khả dụng đường uống, không giống như testosterone, vì nhóm methyl C17α của fluoxymesterone ức chế chuyển hóa lần đầu.[1] Nó có ái lực rất thấp đối với globulin gắn với hormone giới tính trong huyết thanh người (SHBG), ít hơn 5% so với testosterone và ít hơn 1% so với DHT.[20] Thuốc được chuyển hóa ở gan, chủ yếu bằng 6β- hydroxyl hóa, giảm 5α- và 5β, 3α- và 3β-keto-oxy hóa, và 11 -hydroxy-oxy hóa. Các chất chuyển hóa hoạt động được biết đến của nó bao gồm 5α-dihydrofluoxymesterone và 11-oxofluoxymesterone.[6][9][21] Fluoxymesterone có thời gian bán hủy khoảng 9,2 giờ, tương đối dài so với testosterone.[4] Nó được loại bỏ trong nước tiểu, với ít hơn 5% bài tiết không thay đổi.
Hóa học
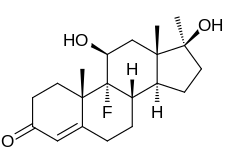
[sửa | sửa mã nguồn]Fluoxymesterone, còn được gọi là 9α-fluoro-11β-hydroxy-17α-methyltestosterone hoặc như 9α-fluoro-17α-methylandrost-4-en-11β, 17β-diol-3-one, là một tổng hợp androstane steroid và một dẫn xuất 17α-alkylated của testosterone (androst-4-en-17β-ol-3-one).[22][23] Nó đặc biệt là dẫn xuất của testosterone với nguyên tử flo ở vị trí C9α, nhóm hydroxyl ở vị trí C11β và nhóm methyl ở vị trí C17α.[22][23]
Tổng hợp
[sửa | sửa mã nguồn]Bước một: Bước đầu tiên trong quá trình tổng hợp fluoxymesterone là quá trình oxy hóa vi sinh của androstenedione có bán trên thị trường (1.11) bởi Actinomyces; điều này giới thiệu một nhóm hydroxyl với 11 vị trí α (1.12), sau đó được oxy hóa thành xê-ri bằng thuốc thử của Jones, thu được 3,11,17-triketone, adrenosterone (1,13). Pyrrolidine sau đó phản ứng để tạo thành một enamine (1,14) bằng phản ứng với các -keto nhóm 3 α, bảo vệ nó khỏi alkyl hóa trong một bước tiếp theo. Tính hồi quy của pyrrolidine cho phản ứng ở vị trí 3 α xảy ra vốn có trong cấu trúc của adrenosterone, do vị trí của các nhóm methyl cồng kềnh. Trong các bước tiếp theo, quá trình kiềm hóa nhóm 17-keto (1.14) bằng thuốc thử Grignard, thêm hydride ở vị trí 11 (1.15) và tái sinh nhóm 3-keto được bảo vệ sẽ tạo ra vật liệu ban đầu (1.16) cho các bước cuối cùng của sự tổng hợp fluoxymesterone. Điều này liên quan đến các biến đổi tổng hợp tiêu chuẩn hơn.

Bước hai: 11 α -hydroxyl của nguyên liệu ban đầu (1.16) được sulfonyl hóa bởi p -toluenesulfonyl chloride; bổ sung trimethylamine (base) làm mất tác dụng của 11 α -carbon, thu được (E 2) loại bỏ tosylate (pka - 5) để cho olefin (1.17). Tính chất lập thể của phản ứng giữa olefin và axit hypobromous (HOBr) trong base, N -bromosuccinimide (NBS), được xác định bởi sự hình thành của chất trung gian bromonium; cation bromonium điện di tiếp cận với mặt α ít bị cản trở nghiêm trọng hơn và bị tấn công bởi mật độ điện tử π của anken. Các ion hydroxide sau đó tấn công từ phía trên vòng (β -face) tại 11-carbon, kết quả trong một cấu trúc (1,18) bằng việc bổ sung lập thể của hydroxyl và brom qua liên kết đôi. Việc bổ sung natri hydroxide dẫn đến sự mất liên kết của 11 α -hydroxyl và cấu trúc tiếp theo trải qua quá trình hình thành vòng epoxy S N 2 nội phân tử. Chiếc nhẫn epoxy của β -epoxide (1,19) được proton để đưa ra một oxironium ion trung gian. Trong một quá trình phối hợp, fluoride tấn công vào mặt a của vòng từ bên dưới, vì một trong hai liên kết oxy-carbon bị phá vỡ ở mặt đối diện; do đó tái sinh trans 11 α -hydroxyl thành nhóm thế flo. Cấu trúc thu được (1.20) là steroid androgenic, fluoxymesterone.
Phát hiện trong dịch cơ thể
[sửa | sửa mã nguồn]Phát hiện halotestin và các steroid đồng hóa bất hợp pháp như vậy trong thể thao đạt được bằng cách xác định GS-MS của steroid đồng hóa bài tiết qua nước tiểu và các chất chuyển hóa của chúng. Trong xét nghiệm halotestin, cặn khô thu được từ mẫu nước tiểu được hòa tan trong dimethylformamide và phức hợp trioxide-pyridine lưu huỳnh và được đun nóng với dung dịch kali cacbonat 1%. Halotestin và nhiều chất chuyển hóa của nó có chứa hai nhóm hydroxyl cực, dẫn đến liên kết hydro liên phân tử làm tăng điểm sôi của chúng và làm giảm độ bay hơi. Để thu được mẫu khí cho GC-MS, các sản phẩm thủy phân được chiết xuất, hòa tan trong metanol và dẫn xuất để tạo ra este trimethylsilyl (TMS) dễ bay hơi bằng cách thêm N -methyl- N -trimethylsilyl-triflu).[24]
Lịch sử
[sửa | sửa mã nguồn]Fluoxymesterone được mô tả lần đầu tiên vào năm 1956 và được giới thiệu sử dụng trong y tế tại Hoa Kỳ vào năm 1957.[1][10] Theo thời gian việc sử dụng fluoxymesterone ngày càng gây tranh cãi và hạn chế.[1]
Xã hội và văn hoá
[sửa | sửa mã nguồn]Tên gốc
[sửa | sửa mã nguồn]Fluoxymesterone là tên chung của thuốc và INN, USP, BAN, DCIT và JAN, trong khi fluoxymestérone là DCF của nó.[22][23][25][26]
Tên biệt dược
[sửa | sửa mã nguồn]Tên biệt dược của fluoxymesterone bao gồm Android-F, Androxy, Halotestin, Ora-Testryl và Ultandren trong số tên khác.[22][23][25][26]
Tính khả dụng
[sửa | sửa mã nguồn]Hoa Kỳ
[sửa | sửa mã nguồn]Fluoxymesterone là một trong số ít AAS vẫn có sẵn cho sử dụng y tế tại Hoa Kỳ.[27] Những loại khác (tính đến tháng 11 năm 2017) là testosterone, testosterone cypionate, testosterone enanthate, testosterone undecanoate, methyltestosterone, nandrolone decanoate, oxandrolone và oxymetholone.[27]
Các nước khác
[sửa | sửa mã nguồn]Sự sẵn có của fluoxymesterone ngoài Hoa Kỳ vẫn còn khan hiếm, nhưng nó được bán ở một số quốc gia khác như México, Moldova và Đài Loan.[1][26]
Tình trạng pháp lý
[sửa | sửa mã nguồn]Fluoxymesterone, cùng với AAS khác, là chất được kiểm soát theo lịch III ở Hoa Kỳ theo Đạo luật về các chất bị kiểm soát.[28]
Tham khảo
[sửa | sửa mã nguồn]- ^ a b c d e f g h i j k l m n o p q r s t u v w x William Llewellyn (2011). Anabolics. Molecular Nutrition Llc. tr. 500–508. ISBN 978-0-9828280-1-4.
- ^ a b c d Kammerer RC, Merdink JL, Jagels M, Catlin DH, Hui KK (1990). “Testing for fluoxymesterone (Halotestin) administration to man: identification of urinary metabolites by gas chromatography-mass spectrometry”. J. Steroid Biochem. 36 (6): 659–66. doi:10.1016/0022-4731(90)90185-u. PMID 2214783.
- ^ a b Thomas L. Lemke; David A. Williams (ngày 24 tháng 1 năm 2012). Foye's Principles of Medicinal Chemistry. Lippincott Williams & Wilkins. tr. 1360–. ISBN 978-1-60913-345-0.
- ^ a b Seth Roberts (2009). Anabolic Pharmacology.
- ^ Thomas L. Lemke; David A. Williams (2008). Foye's Principles of Medicinal Chemistry. Lippincott Williams & Wilkins. tr. 1279–. ISBN 978-0-7817-6879-5.
- ^ a b c d e f Fürstenberger C, Vuorinen A, Da Cunha T, Kratschmar DV, Saugy M, Schuster D, Odermatt A (2012). “The anabolic androgenic steroid fluoxymesterone inhibits 11β-hydroxysteroid dehydrogenase 2-dependent glucocorticoid inactivation”. Toxicol. Sci. 126 (2): 353–61. doi:10.1093/toxsci/kfs022. PMID 22273746.
- ^ a b c d Joseph JF, Parr MK (2015). “Synthetic androgens as designer supplements”. Curr Neuropharmacol. 13 (1): 89–100. doi:10.2174/1570159X13666141210224756. PMC 4462045. PMID 26074745.
- ^ Kicman AT (2008). “Pharmacology of anabolic steroids”. Br. J. Pharmacol. 154 (3): 502–21. doi:10.1038/bjp.2008.165. PMC 2439524. PMID 18500378.
- ^ a b c Charles D. Kochakian (ngày 6 tháng 12 năm 2012). Anabolic-Androgenic Steroids. Springer Science & Business Media. tr. 370, 374, 401, 454, 504–506. ISBN 978-3-642-66353-6.
- ^ a b William Andrew Publishing (ngày 22 tháng 10 năm 2013). Pharmaceutical Manufacturing Encyclopedia, 3rd Edition. Elsevier. tr. 1676–. ISBN 978-0-8155-1856-3.
- ^ Susan M. Ford; Sally S. Roach (ngày 7 tháng 10 năm 2013). Roach's Introductory Clinical Pharmacology. Lippincott Williams & Wilkins. tr. 502–. ISBN 978-1-4698-3214-2.
- ^ http://adisinsight.springer.com/drugs/800012288
- ^ Jerome Z. Litt; Neil Shear (ngày 17 tháng 12 năm 2014). Litt's Drug Eruptions and Reactions Manual, 19th Edition. CRC Press. tr. 177–. ISBN 978-1-84214-599-9.
- ^ a b c d e Kicman, A T (2008). “Pharmacology of anabolic steroids”. British Journal of Pharmacology. 154 (3): 502–521. doi:10.1038/bjp.2008.165. PMC 2439524. PMID 18500378.
- ^ Attardi BJ, Pham TC, Radler LC, Burgenson J, Hild SA, Reel JR (2008). “Dimethandrolone (7alpha,11beta-dimethyl-19-nortestosterone) and 11beta-methyl-19-nortestosterone are not converted to aromatic A-ring products in the presence of recombinant human aromatase”. J. Steroid Biochem. Mol. Biol. 110 (3–5): 214–22. doi:10.1016/j.jsbmb.2007.11.009. PMC 2575079. PMID 18555683.
- ^ Norman T. Adler; Donald Pfaff; Robert W. Goy (ngày 6 tháng 12 năm 2012). Reproduction. Springer Science & Business Media. tr. 630–. ISBN 978-1-4684-4832-0.
- ^ Lo TE, Andal ZC, Lantion-Ang FL (2015). “Fluoxymesterone-induced gynaecomastia in a patient with childhood aplastic anaemia”. BMJ Case Rep. 2015: bcr2014207474. doi:10.1136/bcr-2014-207474. PMC 4434366. PMID 25948845.
- ^ Kirschbaum J (ngày 27 tháng 10 năm 1978). Profiles of Drug Substances, Excipients and Related Methodology. Academic Press. tr. 253–. ISBN 978-0-08-086102-9.
- ^ Mayer M, Rosen F (1975). “Interaction of anabolic steroids with glucocorticoid receptor sites in rat muscle cytosol”. Am. J. Physiol. 229 (5): 1381–6. doi:10.1152/ajplegacy.1975.229.5.1381. PMID 173192.
- ^ Saartok T, Dahlberg E, Gustafsson JA (1984). “Relative binding affinity of anabolic-androgenic steroids: comparison of the binding to the androgen receptors in skeletal muscle and in prostate, as well as to sex hormone-binding globulin”. Endocrinology. 114 (6): 2100–6. doi:10.1210/endo-114-6-2100. PMID 6539197.
- ^ Gordan, G. S. (1976). “Cancer in Man”. Trong Kochakian, Charles D. (biên tập). Anabolic-Androgenic Steroids. tr. 499–513. doi:10.1007/978-3-642-66353-6_16. ISBN 978-3-642-66355-0.
- ^ a b c d J. Elks (ngày 14 tháng 11 năm 2014). The Dictionary of Drugs: Chemical Data: Chemical Data, Structures and Bibliographies. Springer. tr. 568–. ISBN 978-1-4757-2085-3.
- ^ a b c d Index Nominum 2000: International Drug Directory. Taylor & Francis. tháng 1 năm 2000. tr. 461. ISBN 978-3-88763-075-1.
- ^ Schänzer, Willi; Opfermann, Georg; Donike, Manfred (ngày 1 tháng 11 năm 1992). “17-Epimerization of 17α-methyl anabolic steroids in humans: metabolism and synthesis of 17α-hydroxy-17β-methyl steroids”. Steroids. 57 (11): 537–550. doi:10.1016/0039-128X(92)90023-3.
- ^ a b I.K. Morton; Judith M. Hall (ngày 6 tháng 12 năm 2012). Concise Dictionary of Pharmacological Agents: Properties and Synonyms. Springer Science & Business Media. tr. 123–. ISBN 978-94-011-4439-1.
- ^ a b c https://www.drugs.com/international/Fluoxymesterone.html
- ^ a b “Drugs@FDA: FDA Approved Drug Products”. United States Food and Drug Administration. Truy cập ngày 17 tháng 12 năm 2016.
- ^ Steven B. Karch (ngày 21 tháng 12 năm 2006). Drug Abuse Handbook, Second Edition. CRC Press. tr. 30–. ISBN 978-1-4200-0346-8.
