Chất ức chế ribonuclease
| Leucine Rich Repeat (tạm dịch: lặp nhiều leucine) | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| |||||||||
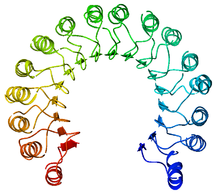
| Sơ đồ dạng dải ruy băng chất ức chế ribonuclease nhìn từ phía trên, trông tựa như móng ngựa.[1] Lớp ngoài là xoắn α, lớp trong là gấp nếp β. Đường kính lớp trong và lớp ngoài khoảng 2.1 nm và 6.7 nm. | |||||||||
| Danh pháp | |||||||||
| Ký hiệu | LRR_1 | ||||||||
| Pfam | PF00560 | ||||||||
| Pfam clan | CL0022 | ||||||||
| InterPro | IPR003590 | ||||||||
| SMART | SM00368 | ||||||||
| SCOP | 1bnh | ||||||||
| |||||||||
Chất ức chế ribonuclease (Ribonuclease inhibitor, RI) là một protein có cấu trúc leucine-rich repeat (tạm dịch là: lặp nhiều leucine). Protein này có kích thước lớn (~ 450 amino acid, ~ 49 kDa), có tính axit (pI ~ 4,7). Protein này tạo phức cực kỳ chặt chẽ với một số ribonuclease. Đây là một loại protein chính của tế bào, chiếm ~ 0,1% trọng lượng của tất cả protein tế bào, đóng vai trò quan trọng trong việc điều hòa thời gian sống của RNA.[2]
RI có hàm lượng cysteine cao (~ 6,5% so với 1,7% ở các protein điển hình) và nhạy cảm với quá trình oxy hóa. RI cũng giàu leucine (21,5% so với 9% trong các protein điển hình) và có tỷ lệ thấp các amino acid kỵ nước như valine, isoleucine, methionine, tyrosine và phenylalanine.
Cấu trúc
[sửa | sửa mã nguồn]
Chất ức chế ribonuclease (RI) là protein dạng leucine-rich repeat (tạm dịch là: lặp nhiều leucine) cổ điển, gồm các xoắn α và gấp nếp β xen kẽ dọc theo trục. Các yếu tố cấu trúc thứ cấp này quấn quanh, chiều bên phải trông giống như móng ngựa. Gấp nếp β và xoắn α song song lần lượt tạo thành thành trong và thành ngoài của móng ngựa. Asparagine giúp ổn định cấu trúc khi mạch chuyển từ chuỗi xoắn α sang chuỗi gấp nếp β, amino acid này phân bố ở mỗi chỗ gập. Các đoạn lặp αβ kế tiếp nhau có độ dài từ 28 đến 29 amino acid, tạo thành một đơn vị gồm 57 amino acid tương ứng với cấu trúc di truyền của nó (mỗi exon mã hóa cho một đơn vị gồm 57 amino acid).
Liên kết với ribonuclease
[sửa | sửa mã nguồn]
Ái lực của chất ức chế ribonuclease đối với ribonuclease là một trong những tương tác mạnh nhất trong tương tác protein-protein. Mặc dù có ái lực cao này, RI có thể liên kết nhiều loại RNases A nhưng khả năng bắt cặp trình tự tương đối thấp. Cả hai nghiên cứu hóa sinh và cấu trúc tinh thể của phức hợp RI-RNase A đều cho thấy rằng tương tác bị chi phối chủ yếu bởi tương tác tĩnh điện, tiếp đến sau đó là diện tích bề mặt.[3][4] Ái lực của RI đối với ribonuclease là vô cùng quan trọng, vì nhiều ribonuclease có tác dụng gây độc tế bào (cytotoxic) và kìm tế bào (cytostasis) tương quan tốt với khả năng liên kết RI.[5]
Chất ức chế ribonuclease ở động vật có vú không thể tạo liên kết với một số thành viên họ ribonuclease tụy không cùng loài. Đặc biệt, RNase của động vật lưỡng cư (chẳng hạn như ranpirnase và amphinase của ếch Rana pipiens) có khả năng lẩn tránh khỏi chất ức chế ribonuclease của động vật có vú. RNase của các loài này có khả năng gây độ tế bào, ứng dụng trong việc tiêu diệt các tế bào ung thư.[6]
Xem thêm
[sửa | sửa mã nguồn]- Guanidinium thiocyanate - một chất ức chế RNase hóa học.
Tham khảo
[sửa | sửa mã nguồn]- ^ a b PDB: 2BNH; Kobe B, Deisenhofer J (1993). “Crystal structure of porcine ribonuclease inhibitor, a protein with leucine-rich repeats”. Nature. 366 (6457): 751–6. doi:10.1038/366751a0. PMID 8264799.
- ^ Shapiro R (2001). “Cytoplasmic ribonuclease inhibitor”. Methods in Enzymology. 341: 611–28. doi:10.1016/S0076-6879(01)41180-3. ISBN 9780121822422. PMID 11582809.
- ^ Lee FS, Shapiro R, Vallee BL (tháng 1 năm 1989). “Tight-binding inhibition of angiogenin and ribonuclease A by placental ribonuclease inhibitor”. Biochemistry. 28 (1): 225–30. doi:10.1021/bi00427a031. PMID 2706246.
- ^ Papageorgiou AC, Shapiro R, Acharya KR (tháng 9 năm 1997). “Molecular recognition of human angiogenin by placental ribonuclease inhibitor--an X-ray crystallographic study at 2.0 A resolution”. The EMBO Journal. 16 (17): 5162–77. doi:10.1093/emboj/16.17.5162. PMC 1170149. PMID 9311977.
- ^ Makarov AA, Ilinskaya ON (tháng 4 năm 2003). “Cytotoxic ribonucleases: molecular weapons and their targets”. FEBS Letters. 540 (1–3): 15–20. doi:10.1016/s0014-5793(03)00225-4. PMID 12681476.
- ^ Ardelt W, Shogen K, Darzynkiewicz Z (tháng 6 năm 2008). “Onconase and amphinase, the antitumor ribonucleases from Rana pipiens oocytes”. Current Pharmaceutical Biotechnology. 9 (3): 215–25. doi:10.2174/138920108784567245. PMC 2586917. PMID 18673287.
Đọc thêm
[sửa | sửa mã nguồn]- Kobe B, Deisenhofer J (tháng 3 năm 1995). “A structural basis of the interactions between leucine-rich repeats and protein ligands”. Nature. 374 (6518): 183–6. doi:10.1038/374183a0. PMID 7877692. S2CID 4364436.
- Kobe B, Deisenhofer J (tháng 12 năm 1996). “Mechanism of ribonuclease inhibition by ribonuclease inhibitor protein based on the crystal structure of its complex with ribonuclease A”. Journal of Molecular Biology. 264 (5): 1028–43. doi:10.1006/jmbi.1996.0694. PMID 9000628.
- Papageorgiou AC, Shapiro R, Acharya KR (tháng 9 năm 1997). “Molecular recognition of human angiogenin by placental ribonuclease inhibitor--an X-ray crystallographic study at 2.0 A resolution”. The EMBO Journal. 16 (17): 5162–77. doi:10.1093/emboj/16.17.5162. PMC 1170149. PMID 9311977.
- Suzuki M, Saxena SK, Boix E, Prill RJ, Vasandani VM, Ladner JE, Sung C, Youle RJ (tháng 3 năm 1999). “Engineering receptor-mediated cytotoxicity into human ribonucleases by steric blockade of inhibitor interaction”. Nature Biotechnology. 17 (3): 265–70. doi:10.1038/7010. PMID 10096294. S2CID 23140257.
- Shapiro R, Ruiz-Gutierrez M, Chen CZ (tháng 9 năm 2000). “Analysis of the interactions of human ribonuclease inhibitor with angiogenin and ribonuclease A by mutagenesis: importance of inhibitor residues inside versus outside the C-terminal "hot spot"”. Journal of Molecular Biology. 302 (2): 497–519. doi:10.1006/jmbi.2000.4075. PMID 10970748.
- Bretscher LE, Abel RL, Raines RT (tháng 4 năm 2000). “A ribonuclease A variant with low catalytic activity but high cytotoxicity”. The Journal of Biological Chemistry. 275 (14): 9893–6. doi:10.1074/jbc.275.14.9893. PMID 10744660.
- Yakovlev GI, Mitkevich VA, Makarov AA (2006). “Ribonuclease inhibitors”. Molecular Biology. 40 (6): 867–874. doi:10.1134/S0026893306060045. S2CID 31887913.
