Cấu trúc protein
Bài viết hoặc đoạn này cần được wiki hóa để đáp ứng tiêu chuẩn quy cách định dạng và văn phong của Wikipedia. |
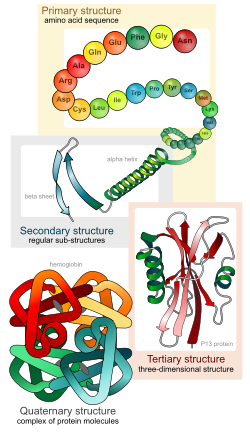
Protein (Protid hay Đạm) là những đại phân tử được cấu tạo theo nguyên tắc đa phân mà các đơn phân là amino acid. Chúng kết hợp với nhau thành một mạch dài nhờ các liên kết peptide (gọi là chuỗi polypeptide). Các chuỗi này có thể xoắn cuộn hoặc gấp theo nhiều cách để tạo thành các bậc cấu trúc không gian khác nhau của protein.
Protein là một hợp chất đại phân tử được tạo thành từ rất nhiều các đơn phân là các amino acid. amino acid được cấu tạo bởi ba thành phần: một là nhóm amine (-NH2), hai là nhóm carboxyl (-COOH) và cuối cùng là nguyên tử cacbon trung tâm đính với 1 nguyên tử Hydro và nhóm biến đổi R quyết định tính chất của amino acide. Người ta đã phát hiện ra có hơn 20 loại amino acid trong thành phần của tất cả các loại protein khác nhau trong cơ thể sống.
Cấu tạo hoá học
[sửa | sửa mã nguồn]- Là hợp chất hữu cơ gồm 4 nguyên tố cơ bản C, H, O, N thường có thêm S và đôi lúc có P.
- Thuộc loại đại phân tử, phân tử lớn nhất dài 0,1 micromet, phân tử lượng có thể đạt tới 1,5 triệu đ.v.C.
- Thuộc loại đa phân tử, đơn phân là các amino acid.
- Có hơn 20 loại amino acid khác nhau tạo nên các prôtêin, mỗi amino acid có 3 thành phần: gốc cacbon (R), nhóm amin (-NH2) và nhóm carboxyl (-COOH), chúng khác nhau bởi gốc R. Mỗi amino acid có kích thước trung bình 3Å.
- Trên phân tử các amino acid liên kết với nhau bằng các liên kết peptide tạo nên chuỗi polypeptide. Liên kết peptide được tạo thành do nhóm carboxyl của amino acid này liên kết với nhóm amin của amino acid tiếp theo và giải phóng 1 phân tử nước. Mỗi phân tử protein có thể gồm một hay nhiều chuỗi polypeptide cùng loại.
- Từ 20 loại amino acid kết hợp với nhau theo những cách khác nhau tạo nên vô số loại prôtêin khác nhau (trong các cơ thể động vật, thực vật ước tính có khoảng 10^14 đến 10^15 loại prôtêin). Mỗi loại prôtêin đặc trưng bởi số lượng, thành phần và trình tự sắp xếp các amino acid trong phân tử. Điều đó giải thích tại sao trong thiên nhiên các prôtêin vừa rất đa dạng, lại vừa mang tính chất đặc thù.
| STT | amino acid | Viết tắt (3 ký tự)[1] | Viết tắt (1 ký tự)[1] | Side-chain polarity[1] | Side-chain charge (pH 7.4)[1] | Hydropathy index[2] | Độ hấp thụ λmax(nm)[3] | ε at λmax (x10−3 M−1 cm−1)[3] |
|---|---|---|---|---|---|---|---|---|
| 1 | Alanine | Ala | A | nonpolar | neutral | 1.8 | ||
| 2 | Arginine | Arg | R | Basic polar | positive | −4.5 | ||
| 3 | Asparagine | Asn | N | polar | neutral | −3.5 | ||
| 4 | Aspartic acid | Asp | D | acidic polar | negative | −3.5 | ||
| 5 | Cysteine | Cys | C | nonpolar | neutral | 2.5 | 250 | 0.3 |
| 6 | Glutamic acid | Glu | E | acidic polar | negative | −3.5 | ||
| 7 | Glutamine | Gln | Q | polar | neutral | −3.5 | ||
| 8 | Glycine | Gly | G | nonpolar | neutral | −0.4 | ||
| 9 | Histidine | His | H | Basic polar | positive(10%)
neutral(90%) |
−3.2 | 211 | 5.9 |
| 10 | Isoleucine | Ile | I | nonpolar | neutral | 4.5 | ||
| 11 | Leucine | Leu | L | nonpolar | neutral | 3.8 | ||
| 12 | Lysine | Lys | K | Basic polar | positive | −3.9 | ||
| 13 | Methionine | Met | M | nonpolar | neutral | 1.9 | ||
| 14 | Phenylalanine | Phe | F | nonpolar | neutral | 2.8 | 257, 206, 188 | 0.2, 9.3, 60.0 |
| 15 | Proline | Pro | P | nonpolar | neutral | −1.6 | ||
| 16 | Serine | Ser | S | polar | neutral | −0.8 | ||
| 17 | Threonine | Thr | T | polar | neutral | −0.7 | ||
| 18 | Tryptophan | Trp | W | nonpolar | neutral | −0.9 | 280, 219 | 5.6, 47.0 |
| 19 | Tyrosine | Tyr | Y | polar | neutral | −1.3 | 274, 222, 193 | 1.4, 8.0, 48.0 |
| 20 | Valine | Val | V | nonpolar | neutral | 4.2 |
Cấu trúc không gian
[sửa | sửa mã nguồn]Protein có 4 bậc cấu trúc cơ bản. 'Cấu trúc bậc 1: Các amino acid nối với nhau bởi liên kết peptit hình thành nên chuỗi polypeptide. Đầu mạch polypeptide là nhóm amin của amino acid thứ nhất và cuối mạch là nhóm carboxyl của amino acid cuối cùng. Cấu trúc bậc một của protein thực chất là trình tự sắp xếp của các amino acid trên chuỗi polypeptide. Cấu trúc bậc một của protein có vai trò tối quan trọng vì trình tự các amino acid trên chuỗi polypeptide sẽ thể hiện tương tác giữa các phần trong chuỗi polypeptide, từ đó tạo nên hình dạng lập thể của protein và do đó quyết định tính chất cũng như vai trò của protein. Sự sai lệch trong trình tự sắp xếp của các amino acid có thể dẫn đến sự biến đổi cấu trúc và tính chất của protein.
Cấu trúc bậc 2 là sự sắp xếp đều đặn các chuỗi polypeptide trong không gian. Chuỗi polypeptide thường không ở dạng thẳng mà xoắn lại tạo nên cấu trúc xoắn α và cấu trúc nếp gấp β, được cố định bởi các liên kết Hydro giữa những amino acid ở gần nhau. Các protein sợi như keratin, Collagen... (có trong lông, tóc, móng, sừng)gồm nhiều xoắn α, trong khi các protein hình cầu có nhiều nếp gấp β hơn.
Cấu trúc bậc 3: Các xoắn α và phiến gấp nếp β có thể cuộn lại với nhau thành từng búi có hình dạng lập thể đặc trưng cho từng loại protein. Cấu trúc không gian này có vai trò quyết định đối với hoạt tính và chức năng của protein. Cấu trúc này lại đặc biệt phụ thuộc vào tính chất của nhóm -R trong các mạch polypeptide. Chẳng hạn nhóm -R của cystein có khả năng tạo cầu đisulfur (-S-S-), nhóm -R của prolin cản trở việc hình thành xoắn, từ đó vị trí của chúng sẽ xác định điểm gấp, hay những nhóm -R ưa nước thì nằm phía ngoài phân tử, còn các nhóm kị nước thì chui vào bên trong phân tử... Các liên kết yếu hơn như liên kết Hydro hay điện hóa trị có ở giữa các nhóm -R có điện tích trái dấu.
Cấu trúc bậc 4: Khi protein có nhiều chuỗi polypeptide phối hợp với nhau thì tạo nên cấu trúc bậc bốn của protein. Các chuỗi polypeptide liên kết với nhau nhờ các liên kết yếu như liên kết Hydro.
Liên kết peptide
[sửa | sửa mã nguồn]Liên kết peptide (-CO-NH-) được tạo thành do phản ứng kết hợp giữa nhóm α –carboxyl của một amino acide này với nhóm α- amin của một amino acide khác, loại đi 1 phân tử nước. Sản phẩm của phản ứng này là một dipeptide. Nếu 3, 4, 5...v.v. hoặc nhiều amino acide kết hợp với nhau, tạo thành các peptide có các tên tương ứng là tripeptide, tetrapeptide, pentapeptide v.v. và polipeptide. Đầu bên trái peptide là đầu C, đầu bên phải peptide là đầu N. Phân tử protein được cấu tạo từ 20 L-α-amino acide các amid tương ứng.
Một số peptide tự nhiên quan trọng:
- Glutathione (tripeptide): γ - glutamyl xistiein glycin. Glutathione có trong tất cả các cơ thể sống, tham gia các phản ứng oxy hóa khử.
- Cacnoxin (dipeptide): β - alanine histidine. Cacnozin có nhiều trong cơ của động vật có xương sống (trừ một số loài cá), vai trò sinh học chưa được xác định rõ nhưng có thể tham gia các quá trình sinh hóa khi cơ hoạt động.
- Oxytocin và Vasopressin: là các notropeptide có cấu trúc có cấu trúc hóa học được biết sớm nhất và cũng đã được tổng hợp hóa học. oxytocin và vasopressin gồm 9 amino acide, trong phân tử có một cầu disulfua.
Ý nghĩa cấu trúc bậc 1 protein
[sửa | sửa mã nguồn]- Là bước đầu tiên quan trọng để xác định cơ sở phân tử hoạt tính sinh học và tính chất hóa lý của protein. Là dấu hiệu rõ nhất về sự sai khác giữa protein này với protein khác.
- Là cơ sở xác định cấu trúc không gian của phân tử protein. Từ những tư liệu về cấu trúc bậc I, trên cơ sở những quy luật hình thành cấu trúc không gian protein, dựa vào cấu trúc không gian của các protein tương đồng, có thể dự đoán sự định vị cầu disulfua, cấu trúc không gian của protein nghiên cứu.
- Là yếu tố góp phần quan trọng trong nghiên cứu bệnh lý phân tử. Nhiều kết quả nghiên cứu đã cho thấy khi thay đổi thứ tự amino acide, thậm chí thay đổi chỉ 1 gốc amino acide trong phân tử protein có thể làm thay đổi hoạt tính sinh học, chức năng của một cơ quan.
- Cấu trúc bậc I là bản phiên dịch mã di truyền. Vì vậy, cấu trúc này nói lên quan hệ họ hàng và lịch sử tiến hóa của thế giới sống.
- Việc xác định được cấu trúc bậc I là cơ sở để tổng hợp nhân tạo protein bằng phương pháp hóa học hoặc các biện pháp công nghệ sinh học.
Sự hình thành bốn bậc cấu trúc protein
[sửa | sửa mã nguồn]Do cách liên kết giữa các amino acide để tạo thành chuỗi polipeptide, trong mạch dài polipeptide luôn lặp lại các đoạn –CO-NH-CH-. Mạch bên của các amino acide không tham gia tạo thành bộ khung của mạch, mà ở bên ngoài mạch polipeptide.
Kết quả nghiên cứu của Paulin và Cori (Linus Pauling, Robert Corey 1930) và những người khác cho thấy nhóm peptide (–CO-NH-CH-) là phẳng và "cứng".
H của nhóm –NH- luôn ở vị trí trans so với O của nhóm carboxyl. Nhưng nhóm peptide có cấu trúc hình phẳng, nghĩa là tất cả các nguyên tử tham gia trong liên kết peptide nằm trên cùng một mặt phẳng. Paulin và Cori đã xác định được khoảng cách giữa N và C của liên kết đơn (1,46 AO) và khoảng cách giữa C và N trong không gian. Trong liên kết đôi –C=N-, khoảng cách này là 1,27 AO. Như vậy, liên kết peptide có một phần của liên kết đôi, có thể hình thành dạng enol
Do đó liên kết peptide "cứng", không có sự tự do quay xung quanh liên kết này. Ngược lại, khả năng quay tự do xung quanh các liên kết nối nhóm peptide với các carbon xung quanh (giữa C và Cα, giữa N và Cα) là rất lớn, mạch peptide có khuynh hướng hình thành cấu trúc xoắn.
Cấu trúc bậc một: chuỗi amino acid cơ bản
[sửa | sửa mã nguồn]Từ các acid amin, nhờ liên kết peptid nối chúng lại với nhau tạo nên chuỗi polypeptid: phần chi tiết
Chuỗi polypeptid là cơ sở cấu trúc bậc I của protein. Tuy nhiên, không phải mọi chuỗi polypeptid đều là protein bậc I. Nhiều chuỗi polypeptid chỉ tồn tại ở dạng tự do trong tế bào mà không tạo nên phân tử protein. Những chuỗi polypeptid có trật tự amino acid xác định thì mới hình thành phân tử protein. Người ta xem cấu tạo bậc I của protein là trật tự các acid amin có trong chuỗi polypeptid. Thứ tự các acid amin trong chuỗi có vai trò quan trọng vì là cơ sở cho việc hình thành cấu trúc không gian của protein và từ đó quy định đặc tính của protein. Phân tử protein ở bậc I chưa có hoạt tính sinh học vì chưa hình thành nên các trung tâm hoạt động. Phân tử protein ở cấu trúc bậc I chỉ mang tính đặc thù về thành phần amino acid, trật tự các amino acid trong chuỗi.
Trong tế bào protein thường tồn tại ở các bậc cấu trúc không gian. Sau khi chuỗi polypeptid - protein bậc I được tổng hợp tại ribosome, nó rời khỏi ribosome và hình thành cấu trúc không gian (bậc II, III, IV) rồi mới di chuyển đến nơi sử dụng thực hiện chức năng của nó.
Cấu trúc bậc hai: Cuộn gấp không gian
[sửa | sửa mã nguồn]Theo Paulin và Cori (1951), có 2 kiểu cấu trúc chính là xoắn α và phiến gấp nếp β.
Cấu trúc xoắn α (α helix): Đoạn mạch polipeptide xoắn chặt lại, những nhóm peptide (-CO-NH-), Cα tạo thành phần bên trong (lõi) của xoắn, các mạch bên (nhóm R) của các gốc amino acide quay ra phía ngoài. mỗi aa được tạo bởi 3 nucleotide. Cấu trúc xoắn α được giữ vững chủ yếu nhờ liên kết hydro. Liên kết hydro được tạo thành giữa các nhóm carboxyl của 1 liên kết peptide với nhóm –NH của liên kết peptide thứ tự sau nó (cách nhau 3 gốc amino acide) trên cùng một mạch polipeptide. Tất cả các nhóm –CO-, -NH- trong liên kết peptide của mạch polipeptide đều tạo thành liên kết hydro theo cách này.
Trong cấu trúc xoắn α, cứ mỗi nhóm –CO-NH- có thể tạo 2 liên kết hydro với 2 nhóm –CO-NH- khác. Các liên kết hydro được tạo thành với số lượng tối đa, bảo đảm độ bền vững của cấu trúc α.
Theo mô hình của Paulin và Cori, trong cấu trúc xoắn giữa 2 gốc amino acide kế tiếp nhau có khoảng cách dọc thep trục xoắn là 1,5AO và góc quay 100O, 1 vòng xoắn có 3,6 gốc amino acide có chiều cao tương ứng là 5,4 AO. Chiều của vòng xoắn có thể là xoắn phải (theo chiều thuận kim đồng hồ) hoặc xoắn trái (ngược chiều kim đồng hồ). Xoắn α trong phân tử protein thường là xoắn phải. Sự tạo thành và độ bền của cấu trúc xoắn α phụ thuộc vào nhiều yếu tố, ví dụ thành phần và trình tự sắp xếp của các amino acide trong mạch polipeptide, pH môi trường,… Đến nay người ta đã biết được một số quy luật cơ bản để tạo thành xoắn α, Vì vậy, nếu xác định được cấu trúc bậc I của phân tử protein thì có thể dự đoán tỉ lệ xoắn α (% số gốc amino acide tham gia tạo thành xoắn) và vị trí của cấu trúc xoắn α trong phân tử protein. Tỉ lệ % xoắn α trong phân tử protein khác nhau thay đổi khá nhiều.
Vi dụ trong hemoglobin và mioglobin là 75%, lozozim là 35%, kimotripsin hầu như không có xoắn α, chỉ có một phần xoắn rất ngắn ở đầu C.
Khi tạo thành cấu trúc xoắn α, khả năng làm quay mặt phẳng ánh sáng phân cực sang bên phải tăng lên, vì thế có thể dựa vào tình chất này để xác định % xoắn trong phân tử protein.
Cấu trúc phiến gấp β (β sheet): Cấu trúc phiến gấp β tìm thấy trong fiborin của tơ, nó khác với xoắn α ở một số điểm như sau
- Đoạn mạch polipeptide có cấu trúc phiến gấp β thường duỗi dài ra chú không cuộn xoắn chặt như xoắn α. Khoảng cách giữa 2 gốc amino acide kề nhau là 3,5AO.
- Liên kết hydro được tạo thành giữa các nhóm –NH- và –CO- trên 2 mạch polipeptide khác nhau, các mạch này có thể chạy cùng hướng hay ngược hướng với nhau.
- Trong phân tử của nhiều protein hình cầu cuộn chặt, còn gặp kiểu cấu trúc "quay- β". Ở đó mạch polipeptide bị đảo hướng đột ngột. Đó là do tạo thành liên kết hydro giữa nhóm –CO của liên kết peptide thứ n với nhóm –NH của liên kết peptide thứ n+2
Cấu trúc kiểu "xoắn colagen": Kiểu cấu trúc này tìm thấy trong phân tử colagen. Thành phần amino acide của colagen rất đặc biệt so với các proteein khác: glycin 35%, prolin 12% tổng số amino acide trong phân tử. Ngoài ra, colagen còn chứa 2 amino acide ít gặp trong các amino acide khác là hydroxiproline và hydroxilizin. Đơn vị cấu trúc của colagen là tropocolagen bao gồm 3 mạch polipeptide bện vào nhau thành một "dây cáp" siêu xoắn (vì mỗi mạch đều có cấu trúc xoắn). 3 mạch polipeptide trong "dây cáp" nối với nhau bằng các liên kết hydro.
Liên kết hydro được tạo thành giữa các nhóm –NH- của gốc glycin trên mạch polipeptide với nhóm -CO- trong liên kết peptide ở trên mạch polipeptide khác. Ngoài ra các nhóm hydroxyl của hydroxipoline cũng tham gia tạo thành liên kết hydro làm tăng độ bền của cấu trúc siêu xoắn.
Ngoài các kiểu cấu trúc bậc II trên, trong phân tử của nhiều protein hình cầu còn có các đoạn mạch không cấu trúc xoắn, phần vô định hoặc cuộn lộn xộn.
Cấu trúc bậc ba: Liên kết disulfid (-S - S-)
[sửa | sửa mã nguồn]
Cấu trúc bậc III được giữ vững nhờ các cầu disulfide, tương tác Van der Waals, liên kết hydro, lực ion. Vì vậy khi phá vỡ các liên kết này phân tử duỗi ra đồng thời làm thay đổi một số tính chất của nó, đặc biệt là tính tan và hoạt tính xúc tác của nó.
Cấu trúc bậc ba là dạng không gian của cấu trúc bậc hai, làm cho phân tử protein có hình dạng gọn hơn trong không gian. Sự thu gọn như vậy giúp cho phân tử protein ổn định trong môi trường sống. Cơ sở của cấu trúc bậc ba là liên kết disulfid. Liên kết được hình thành từ hai phân tử cystein nằm xa nhau trên mạch peptid nhưng gần nhau trong cấu trúc không gian do sự cuộn lại của mạch oevtid. Đây là liên kết đồng hoá trị nên rất bền vững.
Cấu trúc bậc 3 đã tạo nên trung tâm hoạt động của phần lớn các loại enzym. Sự thay đổi cấu trúc bậc ba dẫn đến sự thay đổi hướng xúc tác của enzym hoặc mất khả năng xúc tác hoàn toàn.
Ngoài liên kết disulfit, cấu trúc bậc ba còn được ổn định (bền vững) nhờ một số liên kết khác như:
- Liên kết hydro: liên kết này xuất hiện khi giữa hai nhóm tích điện âm có nguyên tử hydro.
Ví dụ về cấu trúc bậc 3 như phân tử insulin là một polypeptid bao gồm 51 amino acid chuỗi A có 21 gốc acid amin và chuỗi B có 30 gốc acid amin. Hai chuỗi nối với nhau bởi 2 cầu disulfid: cầu thứ nhất giữa gốc cystein ở vị trí 20 của chuỗi A và vị trí 19 của chuỗi B; cầu thứ hai giữa gốc cystein ở vị trí thứ 7 của cả 2 chuỗi. Trong chuỗi A còn có một cầu disulfit giữa 2 gốc cystein ở vị trí thứ 6 và 11. Insulin là hoocmôn tuyến tuỵ tham gia điều hoà hàm lượng đường trong máu. Khi thiếu insulin, hàm lượng đường trong máu tăng cao, dẫn tới hiện tượng bệnh đái đường insulin có tác dụng hạ đường huyết bằng cách xúc tiến quá trình tổng hợp glycogen dự trữ từ glucose.
- Lực Van der Waals: là lực hút giữa hai chất hoặc hai nhóm hoá học nằm cạnh nhau ở khoảng cách 1 - 2 lần đường kính phân tử.
Lực liên kết của các nhóm kỵ nước, những nhóm không phân cực (- CH2; -CH3) trong vang, leucin, isoleucin, phenylalanin... Nước trong tế bào đẩy các gốc này lại với nhau, giữa chúng xảy ra các lực hút tương hỗ và tạo thành các đuôi kỵ nước trong phân tử protein. Do có cấu trúc bậc ba mà các protein có được hình thù đặc trưng và phù hợp với chức năng của chúng. Ở các protein chức năng như enzym và các kháng thể, protein của hệ thống đông máu... thông qua cấu trúc bậc ba mà hình thành được các trung tâm hoạt động là nơi thực hiện các chức năng của protein.
Domain cấu trúc (Structural domain) được nghiên cứu từ 1976, đến nay người ta cho rằng sự hình thành domain rất phổ biến ở các chuỗi peptid tương đối dài. Domain cấu trúc có thể được định nghĩa là những bộ phận, những khu vực trong một phân tử protein được cuộn gấp trong không gian giống như một phân tử protein nhỏ hoàn chỉnh và thường là những nơi thực hiện chức năng liên kết, chức năng lắp ráp của phân tử protein trong hoạt động chức năng của nó. Trong nhiều protein domain gắn liền với chức năng kết hợp đặc hiệu và ở nhiều enzym được cấu tạo từ các domain thì trung tâm hoạt động lại được bố trí ở biên giới của hai hay nhiều domain Sự thành thành các domain trong phân tử protein tạo ra khả năng tương tác linh hoạt giữa các đại phân tử, khả năng cơ động, dịch chuyển tương ứng giữa những bộ phận trong quá trình thực hiện chức năng sinh học. - ở những protein nguồn gốc khác nhau, nhưng có chức năng tương tự thì các domain có cấu trúc tương đối giống nhau.
Cấu trúc bậc bốn: Tổ hợp các tiểu phần
[sửa | sửa mã nguồn]Phân tử protein có cấu trúc bậc IV có thể phân li thuận nghịch thành các tiểu phần đơn vị. Khi phân li, hoạt tính sinh học của nó bị thay đổi hoặc có thể mất hoàn toàn. Do tồn tại tương tác giữa các tiểu phần đơn vị nên khi kết hợp với một chất nào đó dù là phân tử bé cũng kéo theo những biến đổi nhất định trong cấu trúc không gian của chúng.
Là một trạng thái tổ hợp hình thành từ nhiều tiểu phần protein đã có cấu trúc bậc ba hoàn chỉnh. Một số protein có xu hướng kết hợp lại với nhau thành những phức hợp, thành những đại phân tử, không kéo theo sự biến đổi về hoạt tính sinh học.
Rất nhiều trường hợp protein phải tổ hợp lại mới có hoạt tính sinh học. Trong những trường hợp này, cấu trúc bậc bốn là điều kiện để hình thành nên tính năng mới của protein.
Ví dụ về cấu trúc bậc bốn:
- Hemoglobin (Huyết sắc tố) gồm 4 tiểu phần protein: hai tiểu phần α và hai tiểu phần β. Nếu 4 tiểu phần tách rời nhau thì mỗi tiểu phần không thể vận chuyển được một phân tử O2 Khi kết hợp lại thành trạng thái tetramer tạo thành một khối không gian đặc thù gần như hình tứ diện thì mới có khả năng kết hợp và vận chuyển khí oxy. Một phân tử hemoglobin (Hít) vận chuyển được 4 phân tử oxy.
- Enzym glycogen phosphorylase (ở cơ, gan) xúc tác quá trình phân giải glycogen thành glucose.
- Ở trạng thái không hoạt động enzym này ở dạng "b" (dạng hai dimer tách rời nhau).
- Ở trạng thái hoạt động (khi có tín hiệu cần đường) hai dimer tổ hợp lại thành tetramer (dạng "a"). Khi nhu cầu giải phóng glucose giảm, tetramer lại tách thành hai dimer, enzym trở lại dạng không hoạt động.
Tuỳ theo protein mà số lượng monomer có thể thay đổi từ 2,4,6,8 là phổ biến, cá biệt có thể lên tới trên 50 monomer.
Sự hình thành cấu trúc bậc bốn tạo điều kiện cho quá trình điều tiết sinh học thêm tinh vi, chính xác.
Xem thêm
[sửa | sửa mã nguồn]- Hóa sinh học_GS. TSKH. Phạm Thị Trân Châu, Trần Thị Áng, Nhà xuất bản GD
- http://www.hcc.mnscu.edu/chem/V.27/beta_sheet.jpg Lưu trữ 2010-07-22 tại Wayback Machine
- http://www.nku.edu/~russellk/tutorial/peptide/b-sheet.gif
- •http://www.bio.miami.edu/~cmallery/255/255prot/ecb4x10b.jpg Lưu trữ 2010-05-27 tại Wayback Machine
- http://datf.cbi.pku.edu.cn/family_structure/structure_pic/ARID_8_helix_harpin.jpg Lưu trữ 2015-10-14 tại Wayback Machine
Tham khảo
[sửa | sửa mã nguồn]- ^ a b c d Hausman, Robert E.; Cooper, Geoffrey M. (2004). The cell: a molecular approach. Washington, D.C: ASM Press. tr. 51. ISBN 0-87893-214-3.Quản lý CS1: nhiều tên: danh sách tác giả (liên kết)
- ^ Kyte J, Doolittle RF (1982). “A simple method for displaying the hydropathic character of a protein”. Journal of Molecular Biology. 157 (1): 105–32. doi:10.1016/0022-2836(82)90515-0. PMID 7108955.
- ^ a b Freifelder, D. (1983). Physical Biochemistry (ấn bản thứ 2). W. H. Freeman and Company. ISBN 0-7167-1315-2.[cần số trang]
