Benzylamine

| |
| |
| Names | |
|---|---|
| IUPAC name
1-Phenylmethanamine
| |
| Other names
α-Aminotoluene
Benzyl amine Phenylmethylamine | |
| Identifiers | |
3D model (JSmol)
|
|
| ChEBI | |
| ChEMBL | |
| ChemSpider | |
| DrugBank | |
| ECHA InfoCard | 100.002.595 |
| KEGG | |
PubChem <abbr title="<nowiki>Compound ID</nowiki>">CID
|
|
| RTECS number | DP1488500 |
| UNII |
|
CompTox Dashboard (<abbr title="<nowiki>U.S. Environmental Protection Agency</nowiki>">EPA)
|
|
| |
| |
| Properties | |
| C7H9N | |
| Molar mass | 107.156 g·mol−1 |
| Appearance | Colorless liquid |
| Odor | weak, amonia-like |
| Density | 0.981 g/mL[1] |
| Melting point | 10 °C (50 °F; 283 K)[2] |
| Boiling point | 185 °C (365 °F; 458 K)[2] |
| Miscible[2] | |
| Solubility | miscible in ethanol, diethyl ether Hòa tan tốt trong acetone hòa tan trong benzene, chloroform |
| Acidity (pKa) | 9.34[3] |
| Basicity (pKb) | 4.66 |
| -75.26·10−6 cm³/mol | |
Refractive index (nD)
|
1.543 |
| Structure | |
| 1.38 D | |
| Hazards | |
| Main hazards | Flammable |
| Safety data sheet | Fischer Scientific |
| R-phrases (outdated) | R21/22 R34[1] |
| S-phrases (outdated) | S26 S36/37/39 S45[1] |
| NFPA 704 | |
| Flash point | 65 °C (149 °F; 338 K)[1][2] |
| Related compounds | |
Related amines
|
aniline |
Except where otherwise noted, data are given for materials in their standard state (at 25 °C [77 °F], 100 kPa). | |
| Infobox<span typeof="mw:Entity"> </span>references | |
Benzylamine là một hợp chất hóa học hữu cơ có công thức cấu tạo cô đặc C6H5CH2NH 2 (đôi khi được viết tắt là PhCH2 NH2 hoặc BnNH2). Nó bao gồm một nhóm benzyl, C6H5CH2, được gắn vào một nhóm chức amin, NH 2. Chất lỏng không màu này là tiền chất phổ biến trong tổng hợp hữu cơ và được sử dụng trong sản xuất công nghiệp của nhiều loại dược phẩm. Muối hydrochloride được sử dụng để điều trị chứng say tàu xe trong nhiệm vụ Mercury-Atlas 6 trong đó phi hành gia NASA John Glenn trở thành người Mỹ đầu tiên quay quanh Trái đất.
Chế tạo
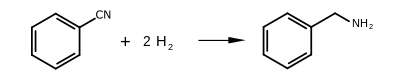
[sửa | sửa mã nguồn]Benzylamine có thể được sản xuất bằng nhiều phương pháp, con đường công nghiệp chính là phản ứng của benzyl chloride và amonia. Nó cũng được sản xuất bằng cách khử benzonitril và khử hóa benzen trên niken Raney.[4]
Nó được tạo ra một cách tình cờ bởi Rudolf Leuckart trong phản ứng của benzen với formamid trong một quá trình hiện được gọi là phản ứng Leuckart,[5] một quá trình chung trong đó quá trình khử aldehyd hoặc ketone tạo ra amin tương ứng.[6][7]
Hóa sinh
[sửa | sửa mã nguồn]Benzylamine xảy ra về mặt sinh học từ hoạt động của enzyme N -substituting formamide biến dạng, được sản xuất bởi vi khuẩn Arthrobacter pascens.[8] Hydrolase này xúc tác cho quá trình chuyển đổi N-benzylformamide thành benzylamine với formate dưới dạng sản phẩm phụ.[9] Benzylamine được suy thoái sinh học do tác động của các enzyme chế monoamine oxidase B,[10] dẫn đến benzaldehyde.[11]
Công dụng
[sửa | sửa mã nguồn]Benzylamine được sử dụng làm nguồn amonia đeo mặt nạ, vì sau khi N-alkyl hóa, nhóm benzyl có thể được loại bỏ bằng cách thủy phân:[12]
- C6H5CH2NH2 + 2 RBr → C6H5CH2NR2 + 2 HBr
- C6H5CH2NR2 + H2 → C6H5CH3 + R2NH
Thông thường, một base được sử dụng trong bước đầu tiên để hấp thụ HBr (hoặc axit liên quan cho các loại tác nhân kiềm hóa khác).
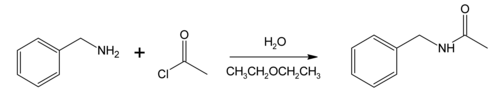
Benzylamine phản ứng với acetyl chloride để tạo thành N -benzylacetamide, một ví dụ điển hình của phản ứng Schotten–Baumann [13] được mô tả lần đầu tiên vào những năm 1880.[14][15] Phản ứng xảy ra trong một hệ dung môi hai pha (ở đây là nước và dietyl ete) để sản phẩm phụ hydro chloride được cô lập trong pha nước (và đôi khi được trung hòa với một base hòa tan) và do đó ngăn không cho proton hóa và cản trở tiến trình của phản ứng. Những điều kiện này thường được gọi là điều kiện phản ứng Schotten-Baumann và được áp dụng chung hơn.[16] Ví dụ cụ thể này hữu ích như là một mô hình cho cơ chế trùng hợp interacial của một diamine với một diacid chloride.[17]
Isoquinolines là một nhóm các hợp chất (benzopyridine) được sử dụng trong bối cảnh y tế (như thuốc gây tê dimethisoquin, thuốc debrisoquine chống tăng huyết áp và thuốc giãn mạch papaverine) và trong các khu vực khác (như thuốc khử trùng N- laurium). Bản thân Isoquinoline được điều chế một cách hiệu quả bằng cách sử dụng phản ứng Pomeranzifer-Fritsch, nhưng cũng có thể được điều chế từ benzylamine và glyoxal acetal bằng một cách tiếp cận tương tự được gọi là điều chỉnh Schlittler-Müller đối với phản ứng Pomeranzedom Fritsch. Sửa đổi này cũng có thể được sử dụng để điều chế isoquinolines thay thế.[18]

Phản ứng aza-Diels-Alder chuyển đổi imine và dien thành tetrahydropyridine trong đó nguyên tử nitơ có thể là một phần của diene hoặc dienophile.[19] Imine thường được tạo ra tại chỗ từ một amin và formaldehyd. Một ví dụ là phản ứng của cyclopentadiene với benzylamine để tạo thành aza- norbornene.[20]
Benzylamine được sử dụng trong nhà sản xuất công nghiệp của nhiều loại dược phẩm, bao gồm alniditan,[21] lacosamide,[22][23] moxifloxacin,[24] và nebivolol.[25] Nó cũng được sử dụng để sản xuất thuốc nổ quân sự hexanitrohexaazaisowurtzitane (HNIW), vượt trội so với chất nổ cao nitroamine cũ như HMX và RDX, mặc dù nó kém ổn định hơn. Hải quân Hoa Kỳ đang thử nghiệm HNIW để sử dụng trong các động cơ tên lửa, như tên lửa, vì nó có các đặc điểm quan sát thấp hơn như khói ít nhìn thấy hơn.[26] HNIW được điều chế bằng cách ngưng tụ đầu tiên benzylamine với glyoxal trong acetonitril trong điều kiện axit và khử nước.[27] Bốn trong số các nhóm benzyl được loại bỏ khỏi hexabenzylhexaazaisowurtzitane bằng cách thủy phân được xúc tác bởi paladi trên carbon và các nhóm amin thứ cấp được acetyl hóa trong anhydrid acetic.[27] Chất trung gian thay thế dibenzyl sau đó được phản ứng với nitronium tetrafluoroborate và nitrosonium tetrafluoroborate trong sulfolane để tạo ra HNIW.[27]
Muối
[sửa | sửa mã nguồn]Muối hydrochloride của benzylamine, C C N Cl hoặc C N HCl,[28] được điều chế bằng cách phản ứng với benzylamine với axit hydrochloric và có thể được sử dụng trong điều trị chứng say tàu x. Phi hành gia của NASA John Glenn đã được cấp bằng benzylamine hydrochloride cho mục đích này cho nhiệm vụ Mercury-Atlas.[29] Các cation trong muối này được gọi là benzylammonium và là một loại thuốc được tìm thấy trong các dược phẩm như thuốc chống giun sán bephenium hydroxynaphthoate, được sử dụng trong điều trị bệnh giun đũa.[30]
Các dẫn xuất khác của benzylamine và muối của nó đã được chứng minh là có đặc tính chống nôn, bao gồm cả những chất có thành phần benzylamine N-(3,4,5-trimethoxybenzoyl).[31] Các chất gây say tàu xe có bán trên thị trường bao gồm cinnarizine và meclizine là dẫn xuất của benzylamine.
Các loại thuốc benzylamine khác
[sửa | sửa mã nguồn]1-Phenylethylamine là một dẫn xuất của benzylamine bị methyl hóa là chirus; hình thức enantiopure có được bằng cách giải quyết các chủng tộc. Hình thức chủng tộc của nó đôi khi được gọi là (±) -α-methylbenzylamine.[32] Cả benzylamine và 1-phenylethylamine đều tạo thành muối amoni ổn định và bắt chước do tính cơ bản tương đối cao của chúng.
An toàn và môi trường
[sửa | sửa mã nguồn]Benzylamine thể hiện độc tính ở miệng khiêm tốn ở chuột với LD50 trên 1130 mg/kg. Nó dễ dàng phân hủy sinh học.[4]
Tham khảo
[sửa | sửa mã nguồn]- ^ a b c d "Benzylamine". Sigma-Aldrich. Truy cập 28 December 2015.
- ^ a b c d Record[liên kết hỏng] in the GESTIS Substance Database of the Institute for Occupational Safety and Health
- ^ Hall, H. K. (1957). "Correlation of the Base Strengths of Amines". J. Am. Chem. Soc. 79 (20): 5441–5444. doi:10.1021/ja01577a030.
- ^ a b Heuer, L. (2006). “Benzylamines”. Ullmann's Encyclopedia of Industrial Chemistry. Wiley-VCH. doi:10.1002/14356007.a04_009.pub2. ISBN 3527306730.
- ^ Crossley, F. S.; Moore, M. L. (1944). “Studies on the Leuckart Reaction”. J. Org. Chem. 9 (6): 529–536. doi:10.1021/jo01188a006.
- ^ Webers, V. J.; Bruce, W. F. (1948). “The Leuckart Reaction: A study of the Mechanism”. J. Am. Chem. Soc. 70 (4): 1422–1424. doi:10.1021/ja01184a038.
- ^ Pollard, C. B.; Young, D. C. (1951). “The Mechanism of the Leuckart Reaction”. J. Org. Chem. 16 (5): 661–672. doi:10.1021/jo01145a001.
- ^ Schomburg, D.; Schomburg, I.; Chang, A. biên tập (2009). “3.5.1.91 N-substituted formamide deformylase”. Class 3 Hydrolases: EC 3.4.22–3.13. Springer Handbook of Enzymes (ấn bản thứ 2). Springer Science & Business Media. tr. 376–378. ISBN 9783540857051.
- ^ Fukatsu, H.; Hashimoto, Y.; Goda, M.; Higashibata, H.; Kobayashi, M. (2004). “Amine-synthesizing enzyme N-substituted formamide deformylase: screening, purification, characterization, and gene cloning”. Proc. Natl. Acad. Sci. 101 (38): 13726–13731. doi:10.1073/pnas.0405082101. PMC 518824. PMID 15358859.
- ^ “MAOB: Monoamine oxidase B – Homo sapiens”. National Center for Biotechnology Information. ngày 6 tháng 12 năm 2015. Truy cập ngày 29 tháng 12 năm 2015.
- ^ Tipton, K. F.; Boyce, S.; O'Sullivan, J.; Davey, G. P.; Healy, J. (2004). “Monoamine oxidases: Certainties and uncertainties”. Curr. Med. Chem. 11 (15): 1965–1982. doi:10.2174/0929867043364810. PMID 15279561.
- ^ Gatto, V. J.; Miller, S. R.; Gokel, G. W. (1993). “4,13-Diaza-18-Crown-6”. Organic Syntheses.; Collective Volume, 8, tr. 152 (example of alklylation of benzylamine followed by hydrogenolysis).
- ^ Li, J. J. (2014). “Schotten–Baumann reaction”. Name Reactions: A Collection of Detailed Mechanisms and Synthetic Applications (ấn bản thứ 5). Springer. tr. 362. ISBN 9783319039794.
- ^ Schotten, C. (1884). “Ueber die Oxydation des Piperidins”. Ber. Dtsch. Chem. Ges. (bằng tiếng Đức). 17 (2): 2544–2547. doi:10.1002/cber.188401702178.
- ^ Baumann, E. (1886). “Ueber eine einfache Methode der Darstellung von Benzoësäureäthern”. Ber. Dtsch. Chem. Ges. 19 (2): 3218–3222. doi:10.1002/cber.188601902348.
- ^ Anderson, N. G. (2012). “5. Solvent Selection”. Practical Process Research and Development – A guide for Organic Chemists (ấn bản thứ 2). Academic Press. tr. 121–168. ISBN 9780123865380.
- ^ Odian, G. (2004). “2.8c – Interfacial Polymerization”. Principles of Polymerization (ấn bản thứ 4). John Wiley & Sons. tr. 90–92. ISBN 9780471274001.
- ^ Li, J. J. (2014). “Schlittler–Müller modification”. Name Reactions: A Collection of Detailed Mechanisms and Synthetic Applications (ấn bản thứ 5). Springer. tr. 492. ISBN 9783319039794.
- ^ Kobayashi, S. (2002). “Catalytic Enantioselective Aza Diels-Alder Reactions”. Trong Kobayashi, S.; Jørgensen, K. A. (biên tập). Cycloaddition Reactions in Organic Synthesis. John Wiley & Sons. tr. 187–210. ISBN 9783527301591.
- ^ Grieco, P. A.; Larsen, S. D. (1990). “N-benzyl-2-azanorbornene”. Organic Syntheses. 68: 206. doi:10.15227/orgsyn.068.0206.
- ^ Lommen, G.; De Bruyn, M.; Schroven, M.; Verschueren, W.; Janssens, W.; Verrelst, J.; Leysen, J. (1995). “The discovery of a series of new non-indole 5HT1D agonists”. Bioorg. Med. Chem. Lett. 5 (22): 2649–2654. doi:10.1016/0960-894X(95)00473-7.
- ^ Choi, D.; Stables, J. P.; Kohn, H. (1996). “Synthesis and anticonvulsant activities of N-Benzyl-2-acetamidopropionamide derivatives”. J. Med. Chem. 39 (9): 1907–1916. doi:10.1021/jm9508705. PMID 8627614.
- ^ Morieux, P.; Stables, J. P.; Kohn, H. (2008). “Synthesis and anticonvulsant activities of N-benzyl-(2R)-2-acetamido-3-oxysubstituted propionamide derivatives”. Bioorg. Med. Chem. 16 (19): 8968–8975. doi:10.1016/j.bmc.2008.08.055. PMC 2701728. PMID 18789868.
- ^ Peterson, U. (2006). “Quinolone Antibiotics: The Development of Moxifloxacin”. Trong IUPAC; Fischer, J.; Ganellin, C. R. (biên tập). Analogue-based Drug Discovery. John Wiley & Sons. tr. 338–342. ISBN 9783527607495.
- ^ Đăng ký phát minh {{{country}}} {{{number}}}, "{{{title}}}", trao vào [[{{{gdate}}}]]. Full text
- ^ Yirka, B. (ngày 9 tháng 9 năm 2011). “University chemists devise means to stabilize explosive CL-20”. Phys.org. Truy cập ngày 28 tháng 12 năm 2015.
- ^ a b c Nair, U. R.; Sivabalan, R.; Gore, G. M.; Geetha, M.; Asthana, S. N.; Singh, H. (2005). “Hexanitrohexaazaisowurtzitane (CL-20) and CL-20-based formulations (review)”. Combust. Explos. Shock Waves. 41 (2): 121–132. doi:10.1007/s10573-005-0014-2.
- ^ “Benzylamine hydrochloride”. Sigma-Aldrich. Truy cập ngày 28 tháng 12 năm 2015.
- ^ Swenson, L. S.; Grimwood, J. M.; Alexander, C. C. “13: Mercury Mission Accomplished (13.1 Preparing a Man to Orbit)”. This New Ocean: A History of Project Mercury. nasa.gov. tr. 413–418.
- ^ Hellgren, U.; Ericsson, Ö.; Aden Abdi, Y.; Gustafsson, L. L. (2003). “Bephenium hydroxynaphthoate”. Handbook of Drugs for Tropical Parasitic Infections (ấn bản thứ 2). CRC Press. tr. 33–35. ISBN 9780203211519.
- ^ Đăng ký phát minh {{{country}}} {{{number}}}, "Benzylamine derivatives", trao vào [[{{{gdate}}}]]. Full text
- ^ PubChem Public Chemical Database (ngày 26 tháng 12 năm 2015). “1-Phenylethylamine”. National Center for Biotechnology Information. Truy cập ngày 29 tháng 12 năm 2015.