Chuẩn độ

Chuẩn độ là một phương pháp định lượng phổ biến trong hóa học phân tích dùng để xác định nồng độ của một chất phân tích đã biết tên nhưng chưa biết nồng độ. Một thuốc thử, được gọi là chất chuẩn độ [1](hay còn gọi là chất chuẩn)[2], được chuẩn bị dưới dạng dung dịch chuẩn có nồng độ và thể tích nhất định. Chất chuẩn độ sẽ phản ứng với chất phân tích để từ đó cho phép chúng ta xác định nồng độ của chất phân tích. Lượng chất chuẩn độ phản ứng với chất phân tích còn được gọi là Thể tích chuẩn độ.
Lịch sử và từ nguyên
[sửa | sửa mã nguồn]phương pháp phân tích thể tích có nguồn gốc từ Pháp vào cuối thế kỷ 18. Nhà hóa học người Pháp François-Antoine-Henri Descroizilles đã phát triển chiếc buret đầu tiên (tương tự như một loại ống đong) vào năm 1791.[3][4][5] Gay-Lussac đã phát triển một phiên bản cải thiện của buret bao gồm một cánh tay bên và cho ra thuật ngữ "pipet" và "buret" trong một bài báo năm 1824 về việc tiêu chuẩn hóa các loại dung dịch chàm.[6] Chiếc buret thực sự được phát minh lần đầu vào năm 1845 bởi nhà hóa học người Pháp Étienne Ossian Henry.[7][8][9][10] Một cải tiến lớn của phương pháp và sự phổ biến của phân tích thể tích là do Karl Friedrich Mohr, người đã thiết kế lại buret thành một dạng đơn giản và tiện lợi, đồng thời là người viết cuốn sách giáo khoa đầu tiên về chủ đề này có tựa đề Lehrbuch der chemisch-analytischen Titrirmethode (tạm dịch: Sách giáo khoa về hóa học phân tích, phương pháp chuẩn độ), xuất bản vào năm 1855.[11][12]
Quy trình
[sửa | sửa mã nguồn]Quy trình chuẩn độ thường bắt đầu bằng một cốc thủy tinh hoặc bình Erlenmeyer chứa một lượng chất phân tích và một lượng nhỏ chất chỉ thị (như phenolphtalein) được đặt bên dưới một buret đã được hiệu chuẩn hoặc ống tiêm pipet hóa học chứa chất chuẩn độ.[13] Sau đó, thêm từ từ chất chuẩn độ vào chất phân tích và chất chỉ thị cho đến khi chất chỉ thị thay đổi màu tương ứng với ngưỡng bão hòa chất chuẩn độ, cho thấy điểm cuối của phép chuẩn độ, nghĩa là lượng chất chuẩn độ cân bằng với lượng chất phân tích có mặt, theo phản ứng giữa hai chất.
Chuẩn bị
[sửa | sửa mã nguồn]Các phép chuẩn độ điển hình cần dùng đến chất chuẩn độ và chất phân tích ở dạng lỏng (hay là dung dịch). Mặc dù chất rắn thường được hòa tan với nước, các dung môi khác như acid acetic hoặc ethanol thì được sử dụng cho một số mục đích đặc biệt (như trong hóa dầu, chuyên về dầu mỏ.) [14] Các chất phân tích đậm đặc thường được pha loãng để cải thiện độ chính xác của quá trình.
Những phép chuẩn độ không phải acid-base cần độ pH ổn định trong suốt quá trình phản ứng. Do đó, dung dịch đệm được thêm vào dung dịch chuẩn độ để duy trì độ pH.[15]
Trong trường hợp hai chất phản ứng trong một mẫu có thể phản ứng với chất chuẩn độ và chỉ một chất trong số đó là chất phân tích mong muốn, có thể thêm dung dịch che phủ vào hỗn hợp phản ứng để loại bỏ tác động của ion không mong muốn.[16]
Một số phản ứng oxid hóa khử có thể cần đun nóng dung dịch mẫu và thực hiện chuẩn độ trong khi dung dịch vẫn còn nóng để tăng tốc độ phản ứng. Ví dụ, quá trình oxy hóa một số dung dịch oxalat cần đun dung dịch ở nhiệt độ 60 °C để duy trì tốc độ phản ứng hợp lý.[17]
Đường cong chuẩn độ
[sửa | sửa mã nguồn]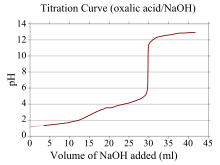
Trong đồ thị dùng trong chuẩn độ, trục x biểu thị thể tích chất chuẩn độ được thêm vào chất phân tích, còn trục y biểu thị nồng độ của chất phân tích ở giai đoạn chuẩn độ tương ứng (trong chuẩn độ acid-base, trục y thường biểu diễn độ pH của dung dịch).[18]
Trong phép chuẩn độ acid– base, đường cong chuẩn độ biểu thị độ mạnh của acid và base tương ứng. Đối với acid mạnh và base mạnh, đường cong tương đối bằng phẳng và sẽ rất dốc ở gần điểm tương đương. Do đó, một sự thay đổi nhỏ về thể tích chất chuẩn độ gần điểm tương đương sẽ dẫn đến sự thay đổi pH lớn. Một số chất chỉ thị phù hợp bao gồm quỳ, phenolphtalein hoặc xanh bromothymol.
Nếu một thuốc thử là acid hoặc base yếu và thuốc thử kia là acid hoặc base mạnh thì đường cong chuẩn độ sẽ không đều và độ pH thay đổi ít hơn khi thêm một lượng nhỏ chất chuẩn độ gần điểm tương đương. Ví dụ, đường cong chuẩn độ cho phép chuẩn độ giữa acid oxalic (một acid yếu) và natri hydroxide (một base mạnh) được minh họa như trên. Điểm tương đương xảy ra trong khoảng pH 8-10, cho thấy dung dịch có tính base tại điểm tương đương và chất chỉ thị như phenolphtalein sẽ phù hợp cho phản ứng này. Đường cong chuẩn độ cho với base yếu và acid mạnh có biểu hiện tương tự, trong đó dung dịch có tính acid ở điểm tương đương nên metyl da cam và bromothymol xanh là các chất chỉ thị thích hợp nhất.
Chuẩn độ giữa acid yếu và base yếu sẽ cho đường cong chuẩn độ không đều. Do đó, không một chất chỉ thị phù hợp nào có thể dùng được nên máy đo pH thường được sử dụng để theo dõi phản ứng.[19]
Loại hàm có thể dùng để mô tả đường cong này là hàm sigmoid .
Các phương pháp chuẩn độ
[sửa | sửa mã nguồn]Chuẩn độ acid-base
[sửa | sửa mã nguồn]| Chỉ số | Màu trong acid | Phạm vi chuyển màu (pH) |
Màu trong base |
|---|---|---|---|
| Tím methyl | Vàng | 0,0—1,6 | Tím |
| Xanh bromophenol | Vàng | 3,0—4,6 | Xanh da trời |
| Cam methyl | Đỏ | 3,1—4,4 | Vàng |
| Đỏ methyl | Đỏ | 4,4—6,3 | Vàng |
| Quỳ tím | Đỏ | 5,0—8,0 | Xanh da trời |
| Xanh bromothymol | Vàng | 6,0—7,6 | Xanh da trời |
| Phenolphtalein | Không màu | 8,3—10,0 | Hồng |
| Vàng alizarin | Vàng | 10,1—12,0 | Đỏ |
Chuẩn độ acid-base về bản chất là sự trung hòa giữa acid và base trong cùng một dung dịch. Ngoài chất cần phân tích, một chất chỉ thị pH thích hợp được thêm vào nó, với độ pH nằm trong phạm vi của điểm tương đương.
Điểm cuối và điểm tương đương không hoàn toàn giống nhau vì điểm tương đương được xác định bằng phép cân bằng hóa học của phản ứng trong khi điểm cuối chỉ là sự thay đổi màu sắc của chất chỉ thị. Vì vậy, việc lựa chọn chất chỉ thị phù hợp sẽ làm giảm sai số của chỉ báo. Ví dụ: nếu điểm tương đương xuất hiện độ pH 8,4 thì phenolphthalein sẽ được sử dụng thay vì alizarin vàng vì phenolphthalein có thể làm giảm sai số do chất chỉ thị gây ra. Bảng trên cho thấy một số loại chất chỉ thị thông thường, màu sắc của chúng và phạm vi pH mà chúng thay đổi màu sắc.[20] Khi cần kết quả chính xác hơn hoặc khi thuốc thử là acid yếu và base yếu, máy đo pH hoặc máy đo độ dẫn điện sẽ được sử dụng thay cho chất chỉ thị.
Đối với các base rất mạnh, như các hợp chất cơ-lithi, amide kim loại và hydride, nước thường không phải là dung môi phù hợp và các chất chỉ thị có pKa nằm trong phạm vi thay đổi pH của dung dịch nước không có tác dụng. Thay vào đó, chất chuẩn độ và chất chỉ thị đều là các acid yếu hơn trong khi các dung môi khan như THF được sử dụng.[21][22]

Độ pH ước tính trong quá trình chuẩn độ có thể được tính dùng ba phép tính. Trước khi bắt đầu chuẩn độ, nồng độ của được tính trong dung dịch acid yếu trước khi thêm base. Khi số mol base được thêm vào bằng số mol acid ban đầu (đạt đến điểm tương đương) thì độ thủy phân và độ pH được tính theo cách tương tự như cách tính base liên hợp của acid đã chuẩn độ. Giữa điểm đầu và điểm cuối, thu được từ phương trình Henderson-Hasselbalch và hỗn hợp chuẩn độ được coi là chất đệm. Trong phương trình Henderson-Hasselbalch, [acid] và [base] được cho là số mol của acid và base có thể tồn tại ngay cả khi phân ly hoặc thủy phân. Trong chất đệm, có thể tính toán chính xác nhưng độ phân ly của HA, độ thủy phân của và khả năng tự ion hóa của nước cần phải được chú ý đến.[23] Bốn phương trình độc lập sau phải được sử dụng:[24]
Trong đó, là số mol acid ( HA ) còn là số mol của muối (XA với X là cation) được sử dụng trong dung dịch đệm và thể tích dung dịch V .Định luật tác dụng khối lượng được áp dụng cho quá trình ion hóa nước và sự phân ly của acid để rút ra phương trình thứ nhất và thứ hai. Trong phương trình thứ ba, tổng của và phải bằng tổng số mol acid và base hòa tan tương ứng, tuân theo định luật bảo toàn khối lượng. Định luật bảo toàn điện tích được sử dụng trong phương trình thứ tư, trong đó vế trái là nồng độ của các cation (dương) và vế phải là nồng độ của các anion (âm): là nồng độ mol của cation.[25]
Chuẩn độ oxid hóa khử
[sửa | sửa mã nguồn]Chuẩn độ oxid hóa khử dựa trên phản ứng oxid hóa khử giữa hai chất. Một chiết áp hoặc một chất chỉ thị oxidhóa khử thường được dùng để xác định điểm cuối của phép chuẩn độ, như khi một trong các thành phần là chất oxy hóa kali dichromat. Sự thay đổi màu của dung dịch từ màu cam sang màu xanh lá cây không rõ ràng, do đó người ta sử dụng chất chỉ thị khác như natri diphenylamine.[26] Phân tích rượu vang để tìm lưu huỳnh dioxide cần iod làm chất oxy hóa. Trong trường hợp này, tinh bột đóng vai là chất chỉ thị; phức hợp tinh bột-iốt màu xanh lam được hình thành khi có lượng iod dư thừa, báo hiệu điểm cuối của phản ứng.[27]
Một số phép chuẩn độ oxid hóa khử không cần chất chỉ thị do các thành phần có màu đậm. Ví dụ, trong chuẩn độ permanganat, màu hồng bền nhẹ báo hiệu điểm cuối của phép chuẩn độ do màu của chất oxy hóa dư là thuốc tím.[28] Trong phép đo iod, ở nồng độ đủ lớn, sự biến mất của ion triiodua màu nâu đỏ đậm có thể được sử dụng làm điểm cuối, mặc dù ở nồng độ thấp hơn, độ nhạy được cải thiện bằng cách thêm chất chỉ thị tinh bột, tạo thành phức hợp có màu xanh đậm với triiodide.

Chuẩn độ pha khí
[sửa | sửa mã nguồn]Chuẩn độ pha khí được sử dụng để xác định các chất phản ứng bằng phản ứng với lượng dư của một số loại khí khác (khí này đồng thời là chất chuẩn độ). Trong một phép chuẩn độ pha khí thông thường, khí ozone được chuẩn độ bằng nitơ oxide theo phản ứng sau:
Sau khi kết thúc phản ứng, chất chuẩn độ và sản phẩm còn lại được định lượng (ví dụ, bằng phương pháp quang phổ biến đổi Fourier) (FT-IR); để xác định lượng chất phân tích trong mẫu ban đầu.
Chuẩn độ pha khí có một vài ưu điểm đáng chú ý so với phép đo quang phổ đơn giản. Thứ nhất, phép đo không phụ thuộc vào độ dày truyền quang, vì cùng một độ dày truyền quang được sử dụng để đo cả chất chuẩn độ dư thừa và sản phẩm. Thứ hai, phép đo không phụ thuộc vào sự thay đổi tuyến tính của độ hấp thụ như là một phương trình của nồng độ chất phân tích như được xác định theo định luật Beer–Lambert. Thứ ba, nó rất hữu ích cho các mẫu có các chất có thể gây ảnh hưởng đến kết quả ở bước sóng được sử dụng cho chất phân tích.[31]
Chuẩn độ tạo phức
[sửa | sửa mã nguồn]Chuẩn độ tạo phưc phụ thuộc vào phản ứng tạo thành phức chất giữa chất phân tích và chất chuẩn.[2] Nói chung, chúng cần các chất chỉ thị tạo phức chuyên biệt tạo thành các phức chất yếu với chất phân tích. Ví dụ phổ biến nhất là việc sử dụng chất chỉ thị tinh bột để tăng độ nhạy của phép chuẩn độ iod do phức hợp tinh bột màu xanh đậm với iod và iodide dễ quan sát hơn so với chỉ dùng iod. Một số chất chỉ thị tạo phức khác là đen Eriochrom T dùng để chuẩn độ ion calci và magnesi, và chất chelat EDTA dùng để chuẩn độ ion kim loại trong dung dịch.[32]
Chuẩn độ điện thế Zeta
[sửa | sửa mã nguồn]Chuẩn độ điện thế Zeta là quá trình chuẩn độ được theo dõi bằng điện thế Zeta để xác định thời điểm kết thúc, thay vì bằng một chất chỉ thị pH, để mô tả các hệ thống không đồng nhất, chẳng hạn như hệ keo.[33] Một trong những ứng dụng là xác định điểm đẳng điện khi điện tích bề mặt bằng 0, đạt được bằng cách thay đổi độ pH hoặc thêm chất hoạt động bề mặt. Một ứng dụng khác là xác định liều lượng tối ưu cho quá trình keo tụ hoặc quá trình ổn định.[34]
Xét nghiệm
[sửa | sửa mã nguồn]Xét nghiệm là một loại chuẩn độ sinh học được sử dụng để xác định nồng độ của virus hoặc vi khuẩn. Pha loãng liên tiếpmột mẫu theo tỷ lệ cố định (chẳng hạn như 1:1, 1:2, 1:4, 1:8, v.v.) cho đến khi lần pha loãng cuối cùng không cho kết quả xét nghiệm dương tính về sự hiện diện của virus. Có thể xác định giá trị dương tính hoặc âm tính bằng cách kiểm tra trực quan các tế bào bị nhiễm dưới kính hiển vi hoặc bằng phương pháp miễn dịch enzyme như xét nghiệm miễn dịch hấp thụ liên kết với enzyme (ELISA). Giá trị này được gọi là giá trị chuẩn độ (titer).[35]
Xác định điểm cuối của phép chuẩn độ
[sửa | sửa mã nguồn]Một số cách để xác định điểm cuối bao gồm:[36]
- Chất chỉ thị: Chất thay đổi màu sắc khi có sự thay đổi hóa học. Chất chỉ thị acid-base (ví dụ: phenolphtalein ) thay đổi màu sắc tùy vào độ pH của dung dịch. Các chỉ số oxidhóa khử cũng được sử dụng. Một giọt dung dịch chỉ thị được thêm vào lúc bắt đầu chuẩn độ; điểm cuối đạt được khi màu sắc thay đổi.
- Chiết áp : Dụng cụ đo điện thế của dung dịch. Chúng được sử dụng để chuẩn độ oxid hóa khử; điện thế của điện cực làm việc sẽ đột ngột thay đổi khi đạt đến điểm cuối.

- Máy đo pH : Một chiết áp có điện cực có điện thế phụ thuộc vào lượng ion H+ có trong dung dịch. (Đây là một ví dụ về điện cực chọn lọc ion.) Độ pH của dung dịch được đo trong suốt quá trình chuẩn độ. Nó cho kết quả chính xác hơn so với chất chỉ thị; tại điểm cuối sẽ có sự thay đổi đột ngột về độ pH.
- Độ dẫn điện : Phép đo ion trong dung dịch. Nồng độ ion có thể thay đổi đáng kể trong quá trình chuẩn độ, làm thay đổi độ dẫn điện. (Ví dụ, trong quá trình chuẩn độ acid-base, các ion H+ và OH− phản ứng với nhau tạo thành H2O trung tính.) Vì tổng độ dẫn điện phụ thuộc vào tất cả các ion có trong dung dịch và không phải tất cả các ion đều đóng góp như nhau (do tính linh động và ion cường độ), việc dự đoán sự thay đổi độ dẫn điện khó hơn việc đo nó.
- Thay đổi màu: Trong một số phản ứng, dung dịch thay đổi màu sắc mà không cần thêm chất chỉ thị. Điều này thường thấy trong các phép chuẩn độ oxid hóa khử khi trạng thái oxy hóa khác nhau của sản phẩm và chất phản ứng tạo ra các màu khác nhau.
- Kết tủa : Nếu phản ứng tạo ra chất rắn thì kết tủa sẽ hình thành trong quá trình chuẩn độ. Một ví dụ kinh điển là phản ứng giữa Ag+ và Cl− để tạo thành kết tủa AgCl. Kết tủa đục thường gây khó khăn cho việc xác định chính xác điểm cuối. Để bù lại, việc chuẩn độ kết tủa thường phải được thực hiện như chuẩn độ ngược(xem bên dưới).
- Nhiệt lượng kế chuẩn độ đẳng nhiệt : Một dụng cụ đo nhiệt lượng được tạo ra hoặc tiêu thụ bởi phản ứng để xác định điểm cuối. Được sử dụng trong các phép chuẩn độ sinh hóa, chẳng hạn như xác định cách thức cơ chất liên kết với enzyme .
- Phép chuẩn độ nhiệt kế : Khác với phép chuẩn độ nhiệt lượng vì nhiệt của phản ứng (được biểu thị bằng sự tăng hoặc giảm nhiệt độ) không được sử dụng để xác định lượng chất phân tích trong dung dịch mẫu. Thay vào đó, điểm cuối được xác định bởi tốc độ thay đổi nhiệt độ .
- Quang phổ : Được sử dụng để đo độ hấp thụ ánh sáng của dung dịch trong quá trình chuẩn độ nếu biết phổ của chất phản ứng, chất chuẩn độ hoặc sản phẩm. Nồng độ của chất có thể được xác định bằng định luật Beer-Lambert .
- Ampe kế : Đo dòng điện được tạo ra bởi phản ứng chuẩn độ do quá trình oxy hóa hoặc khử chất phân tích. Điểm cuối được phát hiện khi có sự thay đổi trong dòng điện. Phương pháp này hữu ích nhất khi có thể giảm lượng chất chuẩn độ dư thừa, như trong phép chuẩn độ halogenua bằng Ag+ .
Điểm cuối và điểm tương đương
[sửa | sửa mã nguồn]Mặc dù thuật ngữ "điểm tương đương" và "điểm cuối" thường được sử dụng thay thế cho nhau nhưng chúng lại là những thuật ngữ khác biệt. Điểm tương đương là sự chấm dứt của phản ứng theo lý thuyết: thể tích chất chuẩn độ được thêm vào mà tại đó số mol chất chuẩn độ bằng số mol chất phân tích[2] hoặc bằng bội số của chúng (như trong acid polyprotic). Điểm cuối là thời điểm xảy ra sự biến đổi tính chất vật lý hay sự đổi màu của chất chỉ thị;[2] sự thay đổi về mặt vật lý cũng có thể được xác định bằng các thiết bị như trên.[37]
Chuẩn độ ngược
[sửa | sửa mã nguồn]Chuẩn độ ngược là chuẩn độ được thực hiện theo chiều ngược lại; Thay vì chuẩn độ mẫu ban đầu, một lượng chất chuẩn dư đã biết được thêm vào chất phân tích và lượng chất chuẩn dư được chuẩn độ bằng dung dịch thuốc thử hỗ trợ khác, đã biết nồng độ chính xác.[2] Chuẩn độ ngược hữu ích nếu dễ xác định điểm cuối của chuẩn độ ngược hơn điểm cuối của chuẩn độ thông thường, như với các phản ứng kết tủa. Chuẩn độ ngược cũng giúp ích nếu phản ứng giữa chất phân tích và chất chuẩn độ rất chậm hoặc khi chất phân tích ở dạng rắn không hòa tan.[38]
Ứng dụng cụ thể
[sửa | sửa mã nguồn]
Chuẩn độ acid-base
[sửa | sửa mã nguồn]- Đối với diesel sinh học : dầu thực vật thải phải được trung hòa trước khi xử lý theo mẻ. Một phần được chuẩn độ bằng base để xác định độ acid, do đó phần còn lại của mẻ có thể được trung hòa đúng cách. Điều này loại bỏ các acid béo tự do khỏi dầu thực vật thải, thường sẽ phản ứng để tạo ra xà phòng thay vì nhiên liệu diesel sinh học.[39]
- Phương pháp Kjeldahl : đo hàm lượng nitơ trong mẫu. Nitơ hữu cơ được phân hủy thành amoniac với acid sulfuric và kali sulfat . Cuối cùng, amoniac được chuẩn độ lại bằng acid boric và sau đó là natri carbonat .[40]
- Chỉ số acid : khối lượng tính bằng miligam kali hydroxide (KOH) cần thiết để chuẩn độ hoàn toàn một acid trong một gam mẫu. Một ví dụ là việc xác định hàm lượng acid béo tự do .
- Giá trị xà phòng hóa : khối lượng tính bằng miligam KOH cần thiết để xà phòng hóa một acid béo có trong một gam mẫu. Quá trình xà phòng hóa được sử dụng để xác định độ dài chuỗi trung bình của acid béo trong chất béo.
- Giá trị ester (hoặc chỉ số ester): chỉ số được tính toán. Giá trị ester = Giá trị xà phòng hóa – Giá trị acid.
- Giá trị amin: khối lượng tính bằng miligam KOH bằng hàm lượng amin có trong một gam mẫu.
- Giá trị hydroxyl : khối lượng tính bằng miligam KOH tương ứng với các nhóm hydroxyl có trong một gam mẫu. Chất phân tích được acetyl hóa bằng anhydride acetic sau đó được chuẩn độ bằng KOH.
Chuẩn độ oxid hóa khử
[sửa | sửa mã nguồn]- Thử nghiệm Winkler về oxy hòa tan : Dùng để xác định nồng độ oxy trong nước. Oxy trong các mẫu nước được khử bằng cách sử dụng mangan(II) sulfat, chất này phản ứng với kali iodide để tạo ra iod . Iốt được giải phóng tỷ lệ với oxy trong mẫu, do đó nồng độ oxy được xác định bằng phép chuẩn độ oxid hóa khử của iốt với thiosulfate sử dụng chất chỉ thị tinh bột.[41]
- Vitamin C : Còn được gọi là acid ascorbic, vitamin C là chất khử mạnh. Có thể dễ dàng xác định nồng độ của nó khi chuẩn độ bằng thuốc nhuộm màu xanh Dichlorophenolindophenol ( DCPIP ), chất này sẽ trở nên không màu khi bị khử bởi vitamin.[42]
- Thuốc thử Benedict : Lượng glucose dư thừa trong nước tiểu có thể giúp phát hiện bệnh tiểu đường ở bệnh nhân. Phương pháp của Benedict là phương pháp thông thường để định lượng glucose trong nước tiểu bằng thuốc thử đã chuẩn bị sẵn. Trong quá trình chuẩn độ này, glucose khử các ion đồng thành các ion dạng đồng phản ứng với kali thiocyanate để tạo ra kết tủa màu trắng, biểu thị điểm cuối.[43]
- Số brom : Thước đo độ không bão hòa của chất phân tích, biểu thị bằng miligram brom được hấp thụ bởi 100 gram mẫu.
- Số iod : Thước đo độ không bão hòa trong chất phân tích, biểu thị bằng gram iod được hấp thụ bởi 100 gram mẫu.
Tham khảo
[sửa | sửa mã nguồn]- ^ Compendium for Basal Practice in Biochemistry. Aarhus University. 2008.
- ^ a b c d e Võ Thị Bạch Huệ (2007). Hóa phân tích (PDF). 1. Nhà xuất bản Giáo dục. tr. 79–80.
- ^ Szabadváry, Ferenc (1993). History of Analytical Chemistry. Taylor & Francis. tr. 208–209. ISBN 2-88124-569-2.
- ^ Descroizilles (1795). “Description et usages du Berthollimêtre, ...” [Description and uses of the Berthollimeter, ...]. Journal des Arts et Manufactures (bằng tiếng Pháp). 1: 256–276.
- ^ Wisniak, Jaime (2014). “François Antoine Henri Descroizilles”. Revista CENIC Ciencias Químicas. 45 (1): 184–193.
- ^ Gay-Lussac (1824). “Instruction sur l'essai du chlorure de chaux” [Instructions on the assaying of chlorinated lime]. Annales de chimie et de physique. 2nd series (bằng tiếng Pháp). 26: 162–175. On pp. 170–171, Gay-Lussac describes various figures that appear in a plate (illustration) that accompanies the article. From p. 170: " F, petite mesure ou pipette de 2+1/2 centimètres cubes, ... " ( F, small measure or "pipette" of 2+1/2 cc., ... ) From p. 171: " I, burette destinée à mesurer la teinture d'épreuve: ... " ( I, "burette" intended to measure the test dye: ... )
- ^ Henry, O. (1845). “Nouvelles expériences sur l'essai des potasses du commerce et appareil dit potassimètre pour l'effectuer” [New experiments on the assay of commercial potash and an apparatus called a "potassimeter" to perform it]. Journale de Pharmacie et de Chimie. 3rd series (bằng tiếng Pháp). 7: 214–222. A sketch of Henry's burette appears on p. 218.
- ^ Szabadváry, Ferenc (1986). “The history of chemical laboratory equipment”. Periodica Polytechnica Chemical Engineering. 30 (1–2): 77–95. See p. 87.
- ^ Szabadváry, Ferenc (1966). History of Analytical Chemistry. Gyula Svehla biên dịch. Oxford, England: Permagon Press. tr. 237. ISBN 9781483157122.
- ^ Christophe, R. (1971). “L'analyse volumétrique de 1790 à 1860. Caractéristiques et importance industrielle. Evolution des instruments” [Volumetric analysis from 1790–1860. Characteristics and industrial importance. Evolution of instruments.]. Revue d'histoire des sciences (bằng tiếng Pháp). 24 (1): 25–44. doi:10.3406/rhs.1971.3172. From p. 38: " ... il préfigure bien ses descendants actuelles ... " ( ... it [i.e., Henry's burette] foreshadows well its modern descendants ... )
- ^ Rosenfeld, L. (1999). Four Centuries of Clinical Chemistry. CRC Press. tr. 72–75. ISBN 90-5699-645-2.
- ^ Mohr, Karl Friedrich (1855). Lehrbuch der chemisch-analytischen Titrirmethode ..., part 1 [Textbook of analytical chemistry titration methods ...] (bằng tiếng Đức). Braunschweig, (Germany): Friederich Vieweg und Sohn. tr. 2–20. Page 3 shows Mohr's burette; page 12 shows a burette with a glass stopcock (Glasshahn).
- ^ Gaiao, Edvaldo da Nobrega; Martins, Valdomiro Lacerda; Lyra, Wellington da Silva; Almeida, Luciano Farias de; Silva, Edvan Cirino da; Araújo, Mário César Ugulino (2006). “Digital image-based titrations”. Analytica Chimica Acta. 570 (2): 283–290. doi:10.1016/j.aca.2006.04.048. PMID 17723410.
- ^ Matar, S.; L.F. Hatch (2001). Chemistry of Petrochemical Processes (ấn bản thứ 2). Gulf Professional Publishing. ISBN 0-88415-315-0.
- ^ Verma, Dr. N.K.; S.K. Khanna; Dr B. Kapila. Comprehensive Chemistry XI. New Delhi: Laxmi Publications. tr. 642–645. ISBN 81-7008-596-9.
- ^ Patnaik, P. (2004). Dean's Analytical Chemistry Handbook (ấn bản thứ 2). McGraw-Hill Prof Med/Tech. tr. 2.11–2.16. ISBN 0-07-141060-0.
- ^ Walther, J.V. (2005). Essentials of Geochemistry. Jones & Bartlett Learning. tr. 515–520. ISBN 0-7637-2642-7.
- ^ Reger, D.L.; S.R. Goode; D.W. Ball (2009). Chemistry: Principles and Practice (ấn bản thứ 3). Cengage Learning. ISBN 978-0-534-42012-3.
- ^ Bewick, S.; J. Edge; T. Forsythe; R. Parsons (2009). CK12 Chemistry. CK-12 Foundation. tr. 794–797.
- ^ “pH measurements with indicators”. Bản gốc lưu trữ ngày 28 tháng 4 năm 2021. Truy cập ngày 29 tháng 9 năm 2011.
- ^ “Titrating Soluble RM, R2NM and ROM Reagents” (PDF). shenvilab.org/education. Bản gốc (PDF) lưu trữ ngày 8 tháng 12 năm 2023. Truy cập ngày 24 tháng 7 năm 2024.
- ^ “Methods for Standardizing Alkyllithium Reagents (literature through 2006)” (PDF). Truy cập ngày 4 tháng 6 năm 2014.
- ^ Harris, Daniel C. (2007). Quantitative Chemical Analysis . Freeman and Company. ISBN 978-0-7167-7041-1.
- ^ Skoog, D.A.; West, D.M.; Holler, F.J. (2000). Analytical Chemistry: An Introduction, seventh edition. Emily Barrosse. tr. 265-305. ISBN 0-03-020293-0.
- ^ Henry, N.; M.M. Senozon (2001). The Henderson-Hasselbalch Equation: Its History and Limitations. Journal of Chermical Education. tr. 1499–1503.
- ^ Vogel, A.I.; J. Mendham (2000). Vogel's textbook of quantitative chemical analysis (ấn bản thứ 6). Prentice Hall. tr. 423. ISBN 0-582-22628-7.
- ^ Amerine, M.A.; M.A. Joslyn (1970). Table wines: the technology of their production. 2 (ấn bản thứ 2). University of California Press. tr. 751–753. ISBN 0-520-01657-2.
- ^ German Chemical Society. Division of Analytical Chemistry (1959). Fresenius' Journal of Analytical Chemistry (bằng tiếng Đức). 166–167. University of Michigan: J.F. Bergmann. tr. 1.
- ^ Hänsch, T.W. (2007). Metrology and Fundamental Constants. IOS Press. tr. 568. ISBN 978-1-58603-784-0.
- ^ “Gas phase titration”. Bureau International des Poids et Mesures. Truy cập ngày 29 tháng 9 năm 2001.
- ^ DeMore, W.B.; M. Patapoff (tháng 9 năm 1976). “Comparison of Ozone Determinations by Ultraviolet Photometry and Gas-Phase Titration”. Environmental Science & Technology. 10 (9): 897–899. Bibcode:1976EnST...10..897D. doi:10.1021/es60120a012.
- ^ Khopkar, S.M. (1998). Basic Concepts of Analytical Chemistry (ấn bản thứ 2). New Age International. tr. 63–76. ISBN 81-224-1159-2.
- ^ Somasundaran, P. biên tập (2006). Encyclopedia of surface and colloid science (ấn bản thứ 2). New York: Taylor & Francis. ISBN 978-0-8493-9615-1.
- ^ Dukhin, Andrei S. (2017). Characterization of liquids, dispersions, emulsions, and porous materials using ultrasound (ấn bản thứ 3). Amsterdam, Netherland ; Cambridge, MA: Elsevier. ISBN 978-0-444-63908-0.
- ^ Decker, Janet M. (2000). Introduction to immunology. 11th hour (ấn bản thứ 3). Malden, Mass: Blackwell Science. ISBN 978-0-632-04415-3.
- ^ “Titration”. Science & Technology Encyclopedia. McGraw-Hill. Truy cập ngày 30 tháng 9 năm 2011.
- ^ Harris, D.C. (2003). Quantitative Chemical Analysis (ấn bản thứ 6). Macmillan. tr. 129. ISBN 0-7167-4464-3.
- ^ Kenkel, J. (2003). Analytical Chemistry for Technicians. Vol. 1 (3 ed.). CRC Press. pp. 108–109.
- ^ Purcella, G. (2007). Do It Yourself Guide to Biodiesel: Your Alternative Fuel Solution for Saving Money, Reducing Oil Dependency, Helping the Planet. Ulysses Press. tr. 81–96. ISBN 978-1-56975-624-9.
- ^ Remington: the science and practice of pharmacy. 1 (ấn bản thứ 21). Lippincott Williams & Wilkins. 2005. tr. 501. ISBN 0-7817-4673-6.
- ^ Spellman, F.R. (2009). Handbook of Water and Wastewater Treatment Plant Operations (ấn bản thứ 2). CRC Press. tr. 545. ISBN 978-1-4200-7530-4.
- ^ Biology. 3. London: Taylor & Francis. 1967. tr. 52.
- ^ Nigam (2007). Lab Manual Of Biochemistry. Tata McGraw-Hill Education. tr. 149. ISBN 978-0-07-061767-4.
Liên kết ngoài
[sửa | sửa mã nguồn]- Wikihow: Thực hiện chuẩn độ
- Hướng dẫn tương tác về chuẩn độ
- Hỗ trợ khoa học: Giải thích đơn giản về phép chuẩn độ bao gồm các ví dụ tính toán Lưu trữ 2011-12-06 tại Wayback Machine
- Phần mềm miễn phí chuẩn độ - mô phỏng mọi đường cong pH so với thể tích, sơ đồ phân phối và phân tích dữ liệu thực
- Phương pháp đồ họa để giải các bài toán acid-base, bao gồm chuẩn độ
- Trình giải các bài toán acid-base tổng quát bằng đồ họa và số - Chương trình phần mềm dành cho điện thoại và máy tính bảng
[[Thể loại:Hóa phân tích]]

![{\displaystyle {\ce {[H+]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/2f6781ee107d64f14c7da0bb7d25c3a8e3c4235f)

![{\displaystyle [{\ce {H+}}][{\ce {OH-}}]=10^{-14}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/e64e80f918a64e1000aa161c7f047b046ed20149)
![{\displaystyle [{\ce {H+}}]=K_{a}{\ce {{\frac {[HA]}{[A^{-}]}}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/9d401c8135577b043dbcb08c4ebc4b3340ce8430)
![{\displaystyle [{\ce {HA}}]+[{\ce {A-}}]={\frac {(n_{{\ce {A}}}+n_{{\ce {B}}})}{V}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/1515a6091588b1b119a198b28d6d1908decca748)
![{\displaystyle [{\ce {H+}}]+{\frac {n_{{\ce {B}}}}{V}}=[{\ce {A-}}]+[{\ce {OH-}}]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/60c7344bbd50c9a75dcb598142e874aa39349a93)


![{\displaystyle V[{\ce {HA}}]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/b2580ec25274d91056971bfecc5c37718436f9c1)
![{\displaystyle V[{\ce {A-}}]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/45100d92fd8e282f61ee30e05034cbe2853523dd)

