Enzyme phiên mã ngược

- Phiên mã ngược là quá trình tổng hợp chuỗi đơn DNA từ khuôn mẫu RNA thông tin.[1], [2], [3]
- Quá trình phiên mã ngược nói trên chỉ thực hiện được nhờ một loại enzyme đặc trưng gọi là enzyme phiên mã ngược.
- Trong hình 1:
- Quá trình mà DNA tạo ra RNA gọi là phiên mã, được xúc tác bởi enzyme phiên mã RNA polymerase.
- Còn quá trình ngược lại mà RNA tạo ra DNA gọi là phiên mã ngược, được xúc tác bởi enzyme phiên mã ngược (reverse transcriptase, viết tắt: RT).
- Bởi vì quá trình này tổng hợp nên DNA, nên enzyme này có chức năng tương tự enzyme DNA-polymeraza trong nhân đôi DNA bình thường; nhưng nó lại dựa vào khuôn mẫu là RNA, nên tên đầy đủ của nó trong các giáo trình Sinh hoá học hoặc Di truyền học phân tử gọi là DNA-polymerase phụ thuộc RNA (RNA-dependent DNA polymerase) hoặc DNA-polymerase tạo bởi RNA (RNA-directed DNA polymerase).[4]
Nguồn gốc thuật ngữ
[sửa | sửa mã nguồn]- Trong lịch sử phát triển của Sinh học phân tử, một trong những nhà khoa học đầu tiên nêu ra vai trò quyết định của DNA trong quá trình di truyền là Francis Crick. Theo ông - trái ngược hẳn với quan niệm trước đó cho rằng vai trò trung tâm của tính di truyền là protein - thì DNA có vai trò trung tâm: DNA tổng hợp ra RNA, rồi - đến lượt nó - RNA tạo ra protein, từ đó biểu hiện thành tính trạng. Điều này được tóm tắt bằng sơ đồ nổi tiếng: DNA RNA Protein.[5] Tư tưởng này đã phản ánh trong Luận thuyết trung tâm của ông.
- Quá trình "DNA RNA" ở sơ đồ trên chính là quá trình phiên mã. Tuy nhiên, do sự phát triển mạnh mẽ của khoa học và công nghệ, người ta đã phát hiện ra rằng: trong cơ thể sinh vật, RNA lại có khả năng tổng hợp ra DNA, ngược lại sơ đồ trên, nghĩa là: RNA DNA và quá trình này gọi là phiên mã ngược.
- Khái niệm phiên mã ngược được dịch từ thuật ngữ tiếng Anh: "retrotranscription" hoặc "reverse transcription", cũng còn được dịch là "sao chép ngược" hoặc "sao mã ngược", dùng để chỉ quá trình mà RNA thông tin được làm khuôn để tạo ra âm bản DNA giống như bản khuôn đã tổng hợp ra nó. Dạng âm bản DNA này là một mạch đơn, bổ sung với mẫu RNA, nên gọi là DNA bổ sung (complementary DNA, viết tắt là cDNA). Xem chi tiết hơn về dạng này ở trang DNA bổ sung.[6]
- Quá trình tạo ra DNA bổ sung này bắt buộc phải có loại enzyme phiên mã ngược - thuật ngữ tiếng Anh: retrotranscriptase.[7] Đây là một nhóm prôtêin có khả năng xúc tác quá trình phiên mã ngược, cũng thường được gọi là reverse transcriptase, hay ngắn gọn hơn là revertaza.[4]
Lược sử phát hiện
[sửa | sửa mã nguồn]| DNA-pôlymêraza phụ thuộc RNA. | |||||||||
|---|---|---|---|---|---|---|---|---|---|
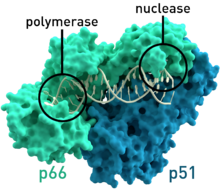
| |||||||||
| Hình 2: Mô hình tinh thể enzym phiên mã ngược của một chủng HIV.[8] | |||||||||
| Danh pháp | |||||||||
| Ký hiệu | RVT_1 | ||||||||
| Pfam | PF00078 | ||||||||
| Pfam clan | CL0027 | ||||||||
| InterPro | IPR000477 | ||||||||
| PROSITE | PS50878 | ||||||||
| SCOP | 1hmv | ||||||||
| CDD | cd00304 | ||||||||
| |||||||||
- Hiện tượng phiên mã ngược được phát hiện bởi Howard Temin tại Đại học Wisconsin-Madison, và được phát hiện một cách độc lập bởi David Baltimore vào năm 1970 tại MIT[9][10]. Cả hai cùng đoạt một giải Nobel năm 1975 giải Nobel Sinh lý và Y khoa chia sẻ cùng với Renato Dulbecco cho thành tựu của cả ba người.
- Khám phá này ban đầu tỏ ra mâu thuẫn với "giáo điều" của Luận thuyết trung tâm trong sinh học phân tử do Francis Crick đề xuất, theo đó: DNA được phiên mã thành RNA rồi mới tổng hợp nên protein. Tuy nhiên, khả năng mà thông tin di truyền có thể "chuyển ngược" theo cách này cuối cùng đã được giới khoa học chấp thuận.[11].
- Đến đầu những năm 1980, virut sao ngược (retrovirus) gây ra bệnh bạch cầu ở người gọi là HTLV-I và HTLV-II được phát hiện. Năm 1983, người ta đã tách lập được HIV và xác định nó là tác nhân gây bệnh AIDS. HIV lây nhiễm các tế bào bạch cầu thuộc dòng tế bào hỗ trợ T, chúng nhân lên nhanh chóng, sinh sôi nảy nở làm hàng loạt tế bào T chết, phá hủy hệ miễn dịch. Trong năm 2007, khoảng 2,1 triệu người trên toàn thế giới đã chết do AIDS, ước tính có 33,2 triệu người sống chung với HIV, và khoảng 2,5 triệu người mới nhiễm HIV.
- Ngày nay, loại enzyme này đã được nghiên cứu kỹ lưỡng (hình 2) và có nhiều ứng dụng quan trong trong công nghệ sinh học phân tử cũng như trong y học. Các loại thuốc ức chế enzyme sao chép ngược là phương pháp điều trị đầu tiên cho những người đang phơi nhiễm HIV. Chất ức chế đầu tiên thuộc loại này là enzyme sao ngược nentori NTR như AZT (zidovudine) - thuốc đầu tiên được Cơ quan quản lý thực phẩm và dược phẩm Hoa Kỳ phê duyệt để kéo dài tuổi thọ của bệnh nhân AIDS, có tác dụng phá huỷ chuỗi DNA tiền virut (proviral DNA) trước khi enzyme kết thúc phiên mã. Các NTR còn được kết hợp với các thuốc ức chế enzyme sao chép ngược không nentori (NTR) như efavirenz, hoạt động bằng cách liên kết và thay đổi hình dạng của enzyme, nên nó coi như bị mất chức năng.
- Như vậy, enzyme phiên mã ngược vốn được phát hiện là loại enzyme có nguồn gốc từ vật liệu di truyền của virut sao ngược xúc tác sự phiên mã của RNA ở virut (axit ribônuclêic) thành DNA (axit đêôxyribônuclêic). Sự xúc tác phiên mã này là quá trình ngược lại của phiên mã tế bào bình thường mà DNA tạo ra RNA, do đó các tên này là sao ngược và "retrovirus" gọi là virut sao ngược. RT chính là bản chất lây nhiễm của virut sao ngược (retrovirus), một số trong số đó gây bệnh ở người, bao gồm virus suy giảm miễn dịch ở người (HIV) gây hội chứng suy giảm miễn dịch mắc phải (AIDS) và virut lymphô ở tế bào T của người I (HTLV-I) gây bệnh bạch cầu. Những bệnh hoặc hội chứng này không di truyền.
- Tuy nhiên, gần đây người ta đã phát hiện các chủng retrovirus có khả năng "chèn" gen của nó vào tế bào mầm, do đó gen này hoàn toàn có khả năng nằm trong bộ gen của giao tử (trứng, tinh trùng) do đó sẽ di truyền cho thế hệ sau.[12] (Xem thêm mục ERV ở trang Nhân tố chuyển vị ngược LTR).
- Ngoài ra, enzyme phiên mã ngược cũng là một thành phần cơ bản của công nghệ phòng thí nghiệm được gọi là phản ứng chuỗi sao chép ngược polymerase (RT-PCR), một công cụ mạnh được sử dụng trong nghiên cứu và chẩn đoán các bệnh như ung thư.[13]
Cơ chế hoạt động
[sửa | sửa mã nguồn]
Ở virus
[sửa | sửa mã nguồn]Nói chung, RT (enzyme phiên mã ngược) trước hết phải có một khuôn mẫu là RNA tương thích với nó.
- Chẳng hạn như HIV có bộ "gene" gồm hai phân tử RNA (hình S ngược sẫm màu trong sơ đồ phải của hình 3), đồng thời tự nhiên cũng phú cho nó sẵn có hai RT riêng tương thích kèm theo. Do đó, khi nhiễm vào người, RT tạo ra mạch đơn DNA bổ sung (cDNA) theo mẫu riêng của nó, mặc dù nó lấy tất cả nguyên, vật liệu của người.
- Tiếp theo, cDNA này biến đổi thành DNA hai mạch xoắn kép, nhờ bộ máy nhân đôi và nguyên, vật liệu của người.
- Cuối cùng DNA mạch kép này "hoành hành" trong tế bào chủ của người là tế bào T (sơ đồ bên trái của hình 3).
Sơ đồ mô tả chi tiết hơn ở hình 4.
Ở nhân thực
[sửa | sửa mã nguồn]
Sau khám phá vạch thời đại của bà Barbara McClintock, người ta đã phát hiện ra rằng phiên mã ngược không chỉ có ở virut và do virut gây ra, mà còn tồn tại một cách tự nhiên ở trong bộ gen của sinh vật nhân thực, trong đó có người. Hệ RT này góp phần quan trọng để tạo ra quá trình chuyển vị ngược gây tái tổ hợp không tương đồng, giúp sinh vật phong phú và đa dạng hơn. Xem chi tiết chuyên đề này ở trang Nhân tố chuyển vị ngược (retrotransposons).
Ngay cả quá trình hình thành cấu trúc cực kỳ quan trọng ở người cũng như rất nhiều loài sinh vật khác, gọi là cấu trúc đầu mút NST hay telomere, cũng cần có RT riêng gọi là telomerase.[14]
Cơ chế hoạt động của các RT trong những trường hợp trên là rất phức tạp, không trình bày ở chuyên khảo này. Có thể tham khảo ở các trang Nhân tố chuyển vị ngược LTR, Gen nhảy v.v.
Nguồn trích dẫn
[sửa | sửa mã nguồn]- ^ Campbell và cộng sự: "Sinh học" - Nhà xuất bản Giáo dục, 2010.
- ^ “Retrotranscription”. Bản gốc lưu trữ ngày 5 tháng 12 năm 2018.
- ^ “Reverse Transcription (cDNA Synthesis)”.
- ^ a b “Reverse transcriptase”.
- ^ SGK "Sinh học 12" - Nhà xuất bản Giáo dục, 2017.
- ^ Y. Kohara. “cDNA”.
- ^ “Retrotranscriptase”.
- ^ PDB: 3KLF; Tu X, Das K, Han Q, Bauman JD, Clark AD Jr, Hou X, Frenkel YV, Gaffney BL, Jones RA, Boyer PL, Hughes SH, Sarafianos SG, Arnold E (tháng 9 năm 2010). “Structural basis of HIV-1 resistance to AZT by excision”. Nat. Struct. Mol. Biol. 17 (10): 1202–9. doi:10.1038/nsmb.1908. PMC 2987654. PMID 20852643.Quản lý CS1: nhiều tên: danh sách tác giả (liên kết)
- ^ doi:10.1038/2261209a0
Hoàn thành chú thích này - ^ doi:10.1038/2261211a0
Hoàn thành chú thích này - ^ doi:10.1038/2261198a0
Hoàn thành chú thích này - ^ David J Griffiths. “Endogenous retroviruses in the human genome sequence”.
- ^ Douglas Morier. “Reverse transcriptase”.
- ^ “Are Telomeres the Key to Aging and Cancer”.

