Liên kết pi
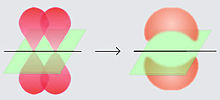
Trong hóa học, liên kết pi (hay liên kết π) là liên kết cộng hóa trị được tạo nên khi hai thùy của một obitan nguyên tử tham gia xen phủ với hai thùy của electron obitan khác tham gia liên kết (sự xen phủ như thế này gọi là sự xen phủ bên của các obitan). Chỉ một trong những mặt phẳng nút của obitan đi qua cả hai hạt nhân tham gia liên kết.
Ký tự Hy Lạp π trong tên của liên kết này ám chỉ các orbitan p, vì sự đối xứng orbitan trong các liên kết pi cũng là sự đối xứng của các orbitan khi xét dọc theo trục liên kết. Các orbitan p thường tham gia vào loại liên kết này. Tuy nhiên, các orbitan d cũng có thể tham gia vào liên kết pi, tạo nên nền tảng cho Liên kết bội kim loại.
Các liên kết pi thường yếu hơn các liên kết sigma do sự phân bố electron (mang điện âm) tập trung ở xa hạt nhân nguyên tử (tích điện dương), việc này đòi hỏi nhiều năng lượng hơn. Liên kết đôi C-C, bao gồm một liên kết sigma và một liên kết pi.[1] có năng lượng liên kết bằng một nửa liên kết đơn C-C, cho thấy tính ổn định do một liên kết pi thêm vào yếu hơn tính ổn định của một liên kết sigma. Từ góc nhìn của cơ học lượng tử, tính chất yếu của liên kết này có thể được giải thích bằng sự xen phủ với một mức độ ít hơn giữa các orbitan-p bởi định hướng song song của chúng. Trái ngược với liên kết sigma, hình thành liên kết ngay tại hạt nhân nguyên tử dẫn đến độ xen phủ lớn hơn.

Ngoài một liên kết sigma, một đôi nguyên tử liên kết qua liên kết đôi và liên kết ba lần lượt có một hoặc hai liên kết pi. Các liên kết pi là kết quả của sự xen phủ các orbitan nguyên tử với hai vùng xen phủ. Các liên kết pi thường là những liên kết trải dài trong không gian hơn các liên kết sigma. Các electron trong các liên kết pi thường được gọi là các electron pi. Các mảng phân tử liên kết bởi một liên kết pi không thể xoay quanh liên kết của chúng mà không làm gãy liên kết pi ấy, do việc làm này phá hủy định hướng song song của các orbitan p cấu thành.
Các liên kết bội
[sửa | sửa mã nguồn]Điển hình là liên kết đôi bao gồm một liên kết sigma và một liên kết pi; ví dụ, liên kết đôi C=C trong etilen. Một liên kết ba điển hình, ví dụ là acetylen, bao gồm một liên kết sigma và hai liên kết pi trong hai mặt phẳng vuông góc chứa trục liên kết. Hai là số lượng liên kết pi tối đa có thể tồn tại giữa một cặp phân tử. Liên kết bốn cực kì hiếm và chỉ có thể hình thành giữa các nguyên tử kim loại chuyển tiếp, trong đó chứa một liên kết sigma, hai liên kết pi và một liên kết delta.
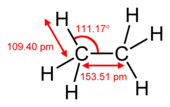
Mặc dù bản thân liên kết pi yếu hơn một liên kết sigma, song liên kết pi là thành phần cấu tạo nên các liên kết bội, cùng với liên kết sigma. Sự kết hợp giữa liên kết pi và sigma mạnh hơn bất kì bản thân một liên kết nào trong hai liên kết ấy. Sức mạnh được gia tăng của một liên kết bội khi đem so với một liên kết đơn (liên kết sigma) có thể được biểu thị bằng nhiều cách, nhưng rõ rệt nhất là bởi sự co độ dài của các liên kết. Ví dụ, trong hóa học hữu cơ, độ dài liên kết cacbon–cacbon vào khoảng 154 pm trong etan,[2][3] 134 pm trong etylen và 120 pm trong acetylen. Có nhiều liên kết khiến cho toàn bộ liên kết ngắn hơn và mạnh hơn.
 |
 |
 |
| etan (1 liên kết σ) | etilen (1 liên kết σ + 1 liên kết π) | acetylen (1 liên kết σ + 2 liên kết π) |
Trường hợp đặc biệt
[sửa | sửa mã nguồn]Các liên kết pi không nhất thiết phải liên kết các đôi nguyên tử cũng được nối kết bởi liên kết sigma.
Trong một số phức chất của kim loại, tương tác pi giữa một nguyên tử kim loại và các orbitan p đối liên kết của ankin (alkyne) và anken (alkene) tạo nên các liên kết pi.
Trong một số trường hợp, trong các liên kết bội giữa hai nguyên tử, chỉ có toàn là các liên kết pi. Các ví dụ bao gồm diiron hexacarbonyl (Fe2(CO)6), dicarbon (C2) và borane B2H2. Trong những hợp chất này, liên kết trung tâm chỉ gồm các liên kết pi, và để đạt được sự xen phủ tối orbitan tối đa, các khoảng cách liên kết phải ngắn hơn thông thường.
Xem thêm
[sửa | sửa mã nguồn]- Liên kết hóa học
- Liên kết delta
- Liên kết sigma
- Tương tác thơm
- Hình học phân tử
- Liên kết pi cho ngược
- Tương tác pi
Tham khảo
[sửa | sửa mã nguồn]- ^ Streitwieser, Andrew; Heathcock, Clayton H.; Kosower, Edward M. (1992). Introduction to organic chemistry. Heathcock, Clayton H., Kosower, Edward M. (ấn bản thứ 4). New York: Macmillan. tr. 250. ISBN 0024181706. OCLC 24501305.
- ^ Veillard, A. (1970). “Relaxation during internal rotation ethane and hydrogen peroxyde”. Theoretica chimica acta. 18 (1): 21–33. doi:10.1007/BF00533694.
- ^ Harmony, Marlin D. (1990). “The equilibrium carbon–carbon single‐bond length in ethane”. J. Chem. Phys. 93: 7522–7523. Bibcode:1990JChPh..93.7522H. doi:10.1063/1.459380.
